
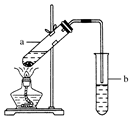
 实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题:
实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题:分析 a种乙醇和乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯,实验时应先加乙醇,后加浓硫酸,最后加乙酸,试管b中碳酸钠溶液可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,加热可加快反应速率,长导管可冷凝回流,充分利用原料,以此来解答.
解答 解:(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后再加入冰醋酸,
故答案为:乙醇;浓硫酸;乙酸;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;酯化(取代)反应;防暴沸;
(3)试管b中加有饱和Na2CO3溶液,其作用是反应掉挥发出来的乙酸;溶解挥发出来的乙醇;减小乙酸乙酯的溶解度,使溶液分层,便于得到乙酸乙酯,
故答案为:反应掉挥发出来的乙酸;溶解挥发出来的乙醇;减小乙酸乙酯的溶解度,使溶液分层,便于得到乙酸乙酯;
(4)反应结束后,振荡试管b,静置.观察到的现象是b中的液体分层,上层是透明的油状液体,
故答案为:试管b中的液体分层,上层是透明的油状液体.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验操作、混合物分离提纯、有机物的性质为解答的关键,侧重分析与实验能力的考查,注意实验安全的分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验1 | 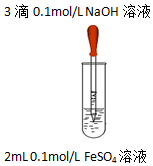 | 实验现象 |
| 液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
| 试管中10mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
| 实验2 | 6mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
| 实验3 | 6mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取25.00mL蒸馏水 | B. | 用分液漏斗分离乙醇和水 | ||
| C. | 用烧杯溶解FeCl3试样 | D. | 用托盘天平称量NaCl固体5.80g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
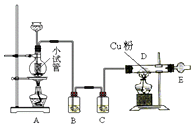 如图是用干燥纯净的Cl2与Cu粉反应来制取无水氯化铜的实验装置图,请回答下列问题:
如图是用干燥纯净的Cl2与Cu粉反应来制取无水氯化铜的实验装置图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [M+]>[OH-]>[A-]>[H+] | B. | [M+]>[A-]>[H+]>[OH-] | C. | [M+]>[A-]>[OH-]>[H+] | D. | [M+]>[H+]=[A-]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
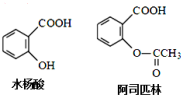
| A. | 1 mol阿司匹林最多可消耗3 molH2 | |
| B. | 水杨酸分子中所有原子不可能共面 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 1 mol阿司匹林最多可消耗2 molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com