
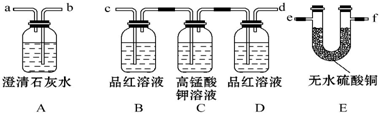
分析 排出的废气中含有CO2、SO2、水蒸气.为检验该废气中的成分,先利用E检验水,再利用BCD组合装置检验并除去二氧化硫,最后利用A检验二氧化碳,以此来解答.
解答 解:排出的废气中含有CO2、SO2、水蒸气.为检验该废气中的成分,先利用E检验水,再利用BCD检验并除去二氧化硫,最后利用A检验二氧化碳,
(1)由上述分析可知,仪器连接的顺序为e-f-c-d-b,故答案为:e-f-c-d-b;
(2)由D中品红溶液不褪色,A中澄清石灰水变浑浊可知有CO2,故答案为:D中品红溶液不褪色,A中澄清石灰水变浑浊;
(3)装置B的作用是检验是否含SO2,装置D的作用是检验SO2是否被完全吸收,故答案为:检验是否含SO2;检验SO2是否被完全吸收.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与实验能力的考查,注意物质的检验顺序,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化都表现为热量变化 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 | |
| D. | 向醋酸钠溶液中滴入酚酞试液,加热后溶液红色加深,说明盐类水解是放热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
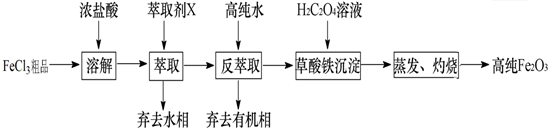
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3→Fe(OH)3 | B. | Al(OH)3→Al2O3 | C. | SO3→H2SO4 | D. | Fe3+→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵增加且放热的反应一定是自发反应 | |
| B. | X?Y+Z正反应吸热,则逆反应必然放热 | |
| C. | 化学反应的焓变△H越大,表示放热越多 | |
| D. | 稀溶液中,酸碱中和反应生成1 mol H2O时放热不一定为57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
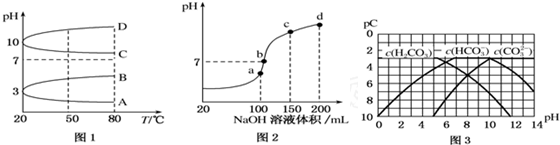
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性 | B. | 还原性 | C. | 碱性 | D. | 酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com