
| A. | C2H2 C2H4 | B. | CH4 C3H6 | C. | CH4 C4H8 | D. | C2H6 C3H8 |
分析 设烃的平均组成为CxHy,根据体积之比等于物质的量之比,利用原子守恒可知平均分子式为C2H5,结合选项,计算C、H原子平均数判断;
解答 解:20mL该混合气体在足量的O2中完全燃烧生成了50mLH2O(g)和40mL CO2(在同温同压下测定),
设烃的平均组成为CxHy,则:
根据C原子守恒有:20x=40,故x=2,
根据H原子守恒有:20y=50×2,故y=5,
即平均分子组成为C2H5,
A.若为C2H2和C2H4,H原子平均数介于2~4之间,不可能为5,故A错误;
B.若为CH4和C3H6,由碳原子可知为二者为1:1混合,H原子平均数为$\frac{4+6}{2}$=5,平均分子组成为C2H5,故B正确
C.CH4、C4H8,二者按照物质的量2:1混合时评平均C原子数为2,但是平均H原子数为:$\frac{4×2+8}{3}$=$\frac{16}{3}$≠5,故C错误;
D.若为C2H6和C3H8,C原子平均数介于2~3之间,H原子平均数介于6~8之间,不能满足平均分子式中C、H原子平均数,故D错误;
故选B.
点评 本题考查了有机物分子式确定的计算、混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握平均值法在化学计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 甲状腺机能亢进 | B. | 佝偻病 | C. | 地方性甲状腺肿 | D. | 雄性激素减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合物中CuO和Fe2O3的物质的量的比为1:1 | |
| B. | 参加反应的CO的质量为11.2g | |
| C. | 原混合物中Fe元素的质量为5.6g | |
| D. | 原混合物中CuO的质量分数约为33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙、丁 | B. | 乙、甲、丙、丁 | C. | 乙、甲、丁、丙 | D. | 丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
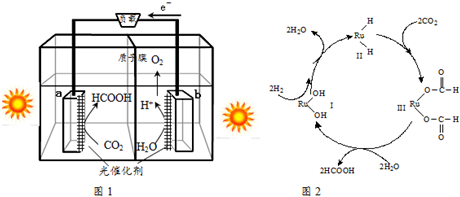
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤⑧ | C. | ⑥⑦⑧ | D. | ③⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com