
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:__________________。
(2)反应I的化学方程式为________________________。
(3)“灼烧”时发生反应的化学方程式:______________。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为__________________。
(5)副产品X的化学式是____________。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为________。
【答案】 2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl 2CuS+3O2
2NH3↑+CaCl2+2H2O NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl 2CuS+3O2 ![]() 2CuO+2SO2 S2O52-+2H+===2SO2↑+H2O CuSO4·5H2O 2∶1
2CuO+2SO2 S2O52-+2H+===2SO2↑+H2O CuSO4·5H2O 2∶1
【解析】(1)实验室利用氯化铵与碱石灰共热制备氨气,该反应为Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑;正确答案:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;正确答案:2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O。
2NH3↑+CaCl2+2H2O。
(2)流程确定反应物为NaCl、NH3、CO2、产物为NH4Cl和碳酸氢钠,反应Ⅰ的化学方程式为: NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl;正确答案:NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl。
(3)硫化铜灼烧一定生成氧化铜和二氧化硫,反应的化学方程式为: 2CuS+3O2 ![]() 2CuO+2SO2 ;正确答案:2CuS+3O2
2CuO+2SO2 ;正确答案:2CuS+3O2 ![]() 2CuO+2SO2 。
2CuO+2SO2 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,硫元素价态不变,为非氧化还原反应,其离子方程式为S2O52-+2H+===2SO2↑+H2O;正确答案:S2O52-+2H+===2SO2↑+H2O。
(5)氧化铜与稀硫酸反应生成硫酸铜和水,因此结晶后得到的X是硫酸铜晶体。副产品X的化学式是CuSO4·5H2O;正确答案:CuSO4·5H2O。
(6)从生产过程可以看出是硫酸铜晶体,从图示中可以看出二氧化碳和水可以再次利用,反应Ⅱ中气体与固体分别是二氧化硫和碳酸钠,这两种物质反应必须生成亚硫酸氢钠;反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3, NaHSO3再生成Na2S2O5,反应方程式为NaCO3+2SO2+H2O=2NaHSO3+CO2,因此气体与固体的物质的量之比为:2:1;正确答案:2:1。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】下列酸性H2CO3>HClO>HCO3—,下列有关叙述中正确的是
①向NaClO溶液中通入少量二氧化碳的离子反应方程式为:2ClO—+CO2+H2O=2HC1O+CO32—
②向KI和KBr混合溶液中,加入足量FeCl3溶液,用CCl4萃取后取上层中的液体少许并加入AgNO3溶液,有淡黄色沉淀生成
③向FeI2溶液中滴加少量氯水。反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl—
④卫生间的洁厕灵不能跟84消毒液混用,其离子方程式为:ClO—+Cl—+2H+=Cl2↑+H2O
A.②④ B.①③ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写错误的是( )
A.![]() +HNO3
+HNO3 ![]()
![]() +H2O
+H2O
B.CH2═CH2+H2O ![]() CH3CH2OH
CH3CH2OH
C.2CH3CHO+O2 ![]() 2CH3COOH
2CH3COOH
D.CH4+Cl2 ![]() CH3Cl+HCl
CH3Cl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题: 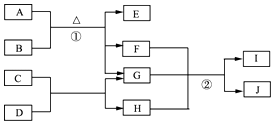
(1)C的化学式为 .
(2)G的电子式为 .
(3)写出①反应的化学方程式: .
(4)写出过量的F参加反应时②的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖是一种单糖,其主要原因解释正确的是( )
A.分子结构最简单
B.在糖类物质中含碳原子最少
C.不能水解生成更简单的糖
D.分子中含有一个醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油通过裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平.下图是由乙烯为原料生产某些化工产品的转化关系图. 
据此回答下列问题.
(1)写出乙烯的一种用途 , 指出乙烯→B的反应类型(选填取代反应或加成反应) .
(2)写出A的结构简式 .
(3)写出X和新制的氢氧化铜悬浊液反应的化学方程式 .
(4)写出B+C→D的化学反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的密闭容器中通入a mol CO和b mol O2,点燃充分反应后容器内碳原子数和氧原子数之比为( )
A. a:b B. a:2b
C. a:(a+2b) D. a:2(a+b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验. 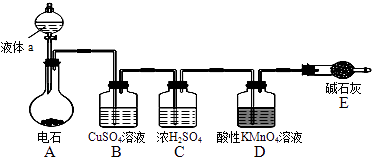
(1)写出实验室制取乙炔的化学方程式: .
(2)实验室制取乙炔时,分液漏斗中的液体a通常是 .
(3)CuSO4溶液的作用是 .
(4)装置D中的现象是: .
(5)工业上常用乙炔、饱和食盐水等物质作原料来合成聚氯乙烯,请写出相关方程式:
; ; ; .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年6月20日,2016年全球最受关注的十大化学成果发布,其中有两项与空气中的二氧化碳处理利用技术有关。其一为美国伊利诺斯大学芝加哥分校和阿贡国家实验室科学家联合设计的新型太阳能电池,可直接把大气中的二氧化碳转化为合成气(CO和H2)该设计同时具有环保和经济价值,不仅可以减缓二氧化碳的排放,而且可以生成重要的化工原料。
(1)下列材料也可以用于制造太阳能电池的是____________。
A.Ag2O B.Fe3O4 C.Si D.SiO2
(2)下图装置可实现二氧化碳到一氧化碳的转化

①电源的正极为______(“A”或“B")。
②阴极发生反应的电极方程式为:___________.
(3)CO 和H2可用于合成甲醇。
①已知CO、H2、CH3OH(1)的燃烧热为283.0kJ/mol、285. 8kJ/mol、726.5kJ/mol,写出 由CO和H2制备CH3OH(1)的热化学方程式__________。
②在398K,1L的恒容容器中充入0.1molCO和0.2molH2,发生反应CO(g)+2H2(g)=CH3OH(g),反应过程中气体的压强如下表所示(atm为标准大气压)。
时间(min) | 0 | 1 | 5 | 10 | 30 | 50 |
压强(atm) | 10 | 9.3 | 8.0 | 7.2 | 4 | 4 |
5min内该反应的平均速率用CO可表示为______,该温度下的平衡常数是_____。达到平衡后,向该容器中通入0.05mol的气态CH3OH,再次达到平衡时,CH3OH的体积分数比原平衡时_____( 填“大”或“小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com