
(1)以下均为中学化学中的常见实验装置,下列有关说法正确的是______。

A.装置①,用于分离沸点不同的两种液态有机物
B.装置②,可用于检验碳酸钠与碳酸氢钠两种固体
C.装置③,可用于CO还原氧化铁实验
D.装置④,适用实验室制取少量乙炔
E.装置⑤,选择合适药品时,可用于制备少量氨气及氧气等
(2)欲量取20.00mL Na2CO3溶液,应选用的仪器是_________________。
(3)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、____________________。
(4)在测定硫酸铜晶体中结晶水含量的实验中,称量操作至少要进行__________次。
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素。
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
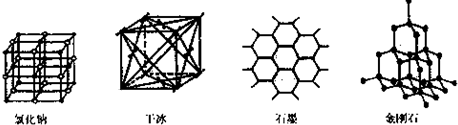
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。

A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
查看答案和解析>>
科目:高中化学 来源:2010年安徽省高三教学质量检测试卷(三)理科综合化学 题型:填空题
(19分)已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为 ,E的基态电子排布式为 ,E3+与E2+的稳定性大小为 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为 ,电负性由小到大的顺序为 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的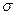 键和
键和 键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为 ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为 。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱 。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为 ,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010年安徽省高考化学质检试卷(三)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com