
| A. | 该过程中溴化物(Br-)得到电子 | |
| B. | 该过程中溴元素被还原,氧元素被氧化 | |
| C. | 该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂 | |
| D. | 该过程中溴元素发生氧化反应,氧元素发生还原反应 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
A、利用该装置准确量取9.20ml硫酸溶液 | B、将洗涤液转移到容量瓶中,应该采取如图的操作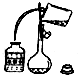 |
| C、过滤和蒸发中都需要使用玻璃棒,且玻璃棒的用途一样 | D、保存NaOH应使用带橡皮塞的玻璃试剂瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Ca2+、Cl2、Br-可以大量共存 | |
| B. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性 | |
| C. | 与FeCl3反应的离子方程式:SO32-+2Fe3++H2O=SO42-+2Fe2++2H+ | |
| D. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-=CaSO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2能与金属活动性顺序表中大多数金属发生化学反应 | |
| B. | N2是大气的主要成分之一,雷雨时,可直接转化为NO2 | |
| C. | 硫是一种淡黄色的能溶于水的晶体,只有氧化性 | |
| D. | 某气体通入澄清石灰水有白色沉淀产生,该气体一定是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) $?_{500℉、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应△H=+2×283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa,22.4LSO2中含有的原子数为3NA | |
| B. | 1 mol S2-中的电子数为18NA | |
| C. | 7.8gNa2O2加入足量的水中,转移的电子数为0.2NA | |
| D. | 在标准状况下,各为l mol的二氧化硫、CCl4的体积均约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com