
【题目】回答下题;
(1)下列原子: ![]() C、
C、 ![]() N、
N、 ![]() Na、
Na、 ![]() H、
H、 ![]() U、
U、 ![]() K、
K、 ![]() U中共有种元素,种核素,互为同位素.
U中共有种元素,种核素,互为同位素.
(2)阴离子的中子数为N:AXn﹣共有x个电子,则N= .
(3)书写电子式 HClONaCl .
【答案】
(1)6;7;23592U和23892U
(2)A﹣x+n
(3)![]() ;
;![]()
【解析】解:(1.)元素的种类由质子数决定,质子数不同,元素的种类就不同,以上共有6种元素;具有一定数目质子和一定数目中子的一种原子就是一种核素,因此共有7种核素;质子数相同,中子数不同,23592U和23892U都是铀元素的不同核素,互为同位素.所以答案是:6;7;23592U和23892U;
(2.)在阴离子中:质子数=核外电子数﹣所带电荷数,即核电荷数=质子数=x﹣n,又根据质量数=质子数+中子数,即中子数=质量数﹣质子数=A﹣(x﹣n).所以答案是:A﹣x+n.
(3.)HClO中O原子分别与H、Cl原子形成共用电子对,电子式为 ![]() ;NaCl为离子化合物,钠离子直接用离子符号表示,氯离子需要标出最外层8个电子,并用其“[]”括起来,右上角表明电荷,电子式为
;NaCl为离子化合物,钠离子直接用离子符号表示,氯离子需要标出最外层8个电子,并用其“[]”括起来,右上角表明电荷,电子式为![]() 所以答案是:
所以答案是: ![]() ;
; ![]()


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.石英与烧碱溶液共热:SiO2+2OH﹣ ![]() SiO32﹣+H2O
SiO32﹣+H2O
B.在氯化铝溶液中滴加过量的氨水:Al3++4OH﹣=[Al(OH)4]﹣
C.在氢氧化钠溶液中通入过量的CO2:2OH﹣+CO2=CO32﹣+H2O
D.稀硫酸与氢氧化钡溶液反应H++SO42﹣+Ba2++OH﹣=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.HNO3有酸性,可用于洗涤附有银镜的试管
B.氧化铁粉末呈红色,可用于制取铁盐
C.SiO2熔点很高,可用于制造坩埚
D.碳酸氢钠能与碱反应,可用作食品膨松剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 11gT2O含有的电子数为5NA
B. 常温下,0.2L 0.5molL﹣1NH4NO3溶液的氮原子数小于0.2NA
C. 含4molHCl的浓盐酸与足量二氧化锰反应转移的电子总数为NA
D. 标准状况下,2.24L H2S全部溶于水所得溶液中HS﹣和S2﹣离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:
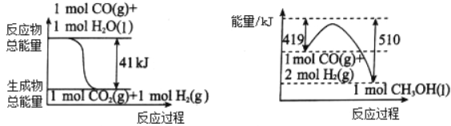
则CO2与H2反应生成CH3OH的热化学方程式为_____________________
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1>0
CO(g)+3H2(g) △H1>0
Ⅱ.CO(g)+2H2(g)![]() CH3OH(g) △H2<0
CH3OH(g) △H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。
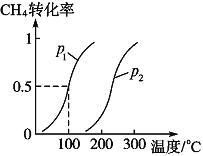
①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为________;
②图中的p1_______p2(填“<”、“>”或“=”),判断的理由是________________________。
③若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是_________(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol·L﹣1)变化如下表所示:
2min | 5min | 10min | |
CO | 0.07 | 0.06 | 0.05 |
H2 | 0.14 | 0.12 | 0.20 |
CH3OH | 0.03 | 0.04 | 0.05 |
若5min时只改变了某一条件,则所改变的条件是_____________;10min时测得各物质浓度如表,10min时v正_______v逆(填“<”、“>”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com