
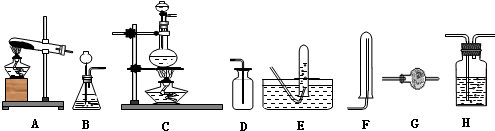
| ��ȡ���� | �������� | ��ȡ����ķ���װ�� | ��ȥ��������ľ���װ�� | �ռ�װ�� | ����װ���� �����Լ� | �����Ƶ����������Լ� |
| NH3 | H2O��g�� |
���� ʵ�����ü��ȹ����Ȼ�狀��������ƵĻ���ﷴӦ���ɰ������Ȼ��ƺ�ˮ���Ʊ��ð����к���ˮ���������ü�ʯ�ҹ�����������ˮ�������ӣ��ռ��������ð�����������ˮ���ȿ������ж��ռ����������鰱�����ð����Ǽ������壬����ʪ��ĺ�ɫʯ����ֽ����ɫ��
��� �⣺ʵ�����ü��ȹ����Ȼ�狀��������ƵĻ���ﷴӦ���ɰ������Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��Ca��OH��2+2NH4Cl$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
�ʴ�Ϊ��Ca��OH��2+2NH4Cl$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
��2����ȡ�����Ǽ��ȹ����Ȼ�狀��������ƵĻ������������ȷ�Ӧ��������ѡ����Թܼ���װ��A����ȥ��������ľ���װ��Ӧѡ����Ը������ѡ��װ��G�еļ�ʯ�Ҹ�������Ǽ�������ˮ�ȿ���������壬�ռ�����Ӧ�������ſ������ռ���ѡ��װ��ΪF�������Ƶ����������Լ������ð����Ǽ������壬����ʪ��ĺ�ɫʯ����ֽ����ɫ��
�ʴ�Ϊ��
| NH3 | H2O��g�� | A | G | F | e | g |
���� ���⿼���˰���ʵ�����Ʊ���������ӡ��ռ���ʵ�����������װ�ú��Լ���ѡ�����ջ����ǽ���ؼ�����Ŀ�ϼ�


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
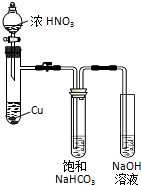 ij��ѧѧϰС�鷢���ڼ�����Һ�У�NO2�ᷢ�����·�Ӧ��
ij��ѧѧϰС�鷢���ڼ�����Һ�У�NO2�ᷢ�����·�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg2+ AlO2- | B�� | Na+��SO42- | C�� | Cu2+��SO42- | D�� | Na+��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
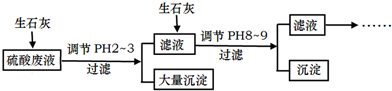
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C��s��+H2O��g��?CO��g��+H2��g�� �������C���壬V�� ����V�� ��С | |
| B�� | Zn��s��+HCl��aq���TZnCl2��aq��+H2��g����ʹ�ô�п�ȴ�п��Ӧ���ʿ� | |
| C�� | ���ڷ�ӦH2��g��+I2��g��?2HI��g�������º��ݳ���Ne��������ѹǿ����V����V�� ������ | |
| D�� | ���ڷ�Ӧ2SO2��g��+O2��g���T2SO3��g���������¶�V����V�� ���ӿ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 56g���������е�ԭ����ĿΪNA | |
| B�� | ��״���£�22.4L���к���NA��ˮ���ӻ�ѧ��Ӧ�� | |
| C�� | 0.5mol����þ���þ����ʱʧȥ���ӵ���ĿΪNA | |
| D�� | ��״���£�22.4L����������ԭ����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ������Һ�л�������NaCl�������л�������NaCl | |
| B�� | Fe��OH��3�����л������������������Һ�л�������KI��Һ | |
| C�� | Na2CO3�������NaHCO3��NaHCO3�������Na2CO3 | |
| D�� | CO2�������SO2��CO2�������HCl���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
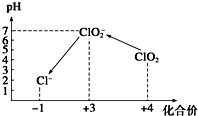 ClO2������һ�ֳ��õ����������������ҹ���ClO2��������������ˮ����������
ClO2������һ�ֳ��õ����������������ҹ���ClO2��������������ˮ�����������鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com