
【题目】废旧钴金属片中的钴有+2价和+3价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回收钴的工艺流程如下:
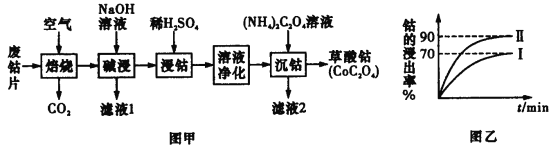
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是____________________(任写一条)。
(2)该流程中浸钴时,钴的浸出率最高只能达到70%,后来改进方法,加入使用硫酸进行第一次浸取后,再加入Na2SO3溶液进行第二次浸取,从而使钴的浸出率达90%以上,写出第二次浸出钴时溶液中发生反应的离子方程式:____________________。
(3)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液pH为1.5~2.0后,加H2O2,反应一段时间,加8%Na2CO3溶液,将溶液的pH调至4.0~5.0。已知Fe(OH)3的溶度积常数为4×10-38,则当溶液的pH调至4.0时,溶液中的c(Fe3+)=__________mol·L-1。
②除锰:加入NaClO溶液。写出该离子方程式:____________________。
③减钙镁:加入NH4F溶液,沉淀大部分的钙、镁的离子。

试解释为何草酸铵溶液沉钴前要减钙镁:______________________________。
(4)滤液2的主要成分为____________________(以化学式表示)。
(5)得到的草酸钴沉淀须洗涤干燥。写出检验沉淀已被洗净的操作与现象__________。
【答案】将废旧钴金属片粉碎(或其他合理答案均可) Co2O3+ SO32-+4H+ =2Co2++ SO42-+2H2O; 4×10-8 2MnO2+ClO-+4H+=2Mn2++ ClO3-+2H2O 排除钙、镁的离子对CoC2O4的制备的干扰 (NH4)2SO4 取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净
【解析】
)焙烧含有锰、铁、钙、镁、铝等金属元素及碳粉的废旧钴金属片,使其金属变成相应的氧化物,加碱后过滤除去铝元素,剩余的氧化物加稀硫酸后,铁、钙、镁的金属氧化物溶解,MnO2不溶于稀酸,所以加NaClO溶液进行除杂,溶液进化后加入草酸铵,使溶液中的钴离子变成草酸钴沉淀。以此分析解答。
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是将金属片粉碎,增大接触面积,使反应充分,故答案:将废旧钴金属片粉碎。
(2)废旧钴金属片中的钴有+2价和+3价,经过煅烧后,+2价Co变成+3价,所以Co2O3和Na2SO3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,所以反应的离子方程式为Co2O3+ SO32-+4H+ =2Co2++ SO42-+2H2O,故答案:Co2O3+ SO32-+4H+ =2Co2++ SO42-+2H2O;
(3)①由已知Fe(OH)3的溶度积常数为4×10-38,当溶液的pH调至4.0时,c(OH-)=10-10 mol·L-1,所以c(Fe3+)=![]() =
=![]() =4×10-8 mol·L-1,所以答案:4×10-8;
=4×10-8 mol·L-1,所以答案:4×10-8;
②经过煅烧后,锰生成MnO2,既不溶于碱也不溶于稀酸,所以在酸性条件下, MnO2和NaClO能发生反应,该反应的离子方程式:2MnO2+ClO-+4H+=2Mn2++ ClO3-+2H2O,故答案:2MnO2+ClO-+4H+=2Mn2++ ClO3-+2H2O;
③加入NH4F溶液,溶液中的钙、镁离子发生反应生成了CaF2、MgF2沉淀,因为Ksp(CoC2O4)=1.7![]() 10-7, Ksp(CaC2O4)=6.4
10-7, Ksp(CaC2O4)=6.4![]() 10-9,Ksp(MgC2O4)=5
10-9,Ksp(MgC2O4)=5![]() 10-6,所以沉淀CoC2O4时,钙、镁的离子也会有沉淀,干扰CoC2O4的制备,所以在加草酸铵溶液沉钴前要减钙镁,故答案:排除钙、镁的离子对CoC2O4的制备的干扰;
10-6,所以沉淀CoC2O4时,钙、镁的离子也会有沉淀,干扰CoC2O4的制备,所以在加草酸铵溶液沉钴前要减钙镁,故答案:排除钙、镁的离子对CoC2O4的制备的干扰;
(4)减钙镁处理后溶液中含有硫酸根离子,加入草酸铵后,溶液中还会有铵根离子,所以滤液2的主要成分为硫酸铵,其化学式表示为:(NH4)2SO4,故答案:(NH4)2SO4;
(5)加入(NH4)2C2O4反应生成CoC2O4,溶液中可能含有SO42-,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是:取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净,故答案:取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净。


科目:高中化学 来源: 题型:
【题目】能说明![]() 元素原子的得电子能力强于
元素原子的得电子能力强于![]() 元素原子的事实是( )
元素原子的事实是( )
A.![]() 元素位于
元素位于![]() 元素的上一个周期
元素的上一个周期
B.![]() 元素的含氧酸的酸性强于
元素的含氧酸的酸性强于![]() 元素的含氧酸
元素的含氧酸
C.分别加热![]() 、
、![]() 的简单氢化物
的简单氢化物![]() 、
、![]() 至500℃,只有
至500℃,只有![]() 发生分解
发生分解
D.![]() 元素与
元素与![]() 元素位于同一主族,在相同温度下二者的单质与铜反应分别生成
元素位于同一主族,在相同温度下二者的单质与铜反应分别生成![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.制取环氧乙烷:CH2=CH2+Cl2+Ca(OH)2→![]() +CaCl2+H2O,原子利用率为53.8%
+CaCl2+H2O,原子利用率为53.8%
B.煤在气化过程中脱硫可以减少污染
C.食品添加剂加入到食品中目的是防腐、保鲜等
D.锂电池应用广泛的主要原因是比能量高、可储存时间长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于新制氯水及久置氯水的说法中不正确的是( )
A.新制的氯水呈黄绿色,久置的氯水变为无色
B.新制的氯水漂白作用强,久置的氯水漂白作用很弱
C.新制的氯水所含微粒种类多,久置的氯水所含微粒种类较少
D.新制的氯水中无氯离子,久置的氯水中含有氯离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1)应用托盘天平称取十水碳酸钠晶体_______g
(2)若在称量样品时,药品放在天平右盘上,磕码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为_________(同一步骤可用多次)
A、调整零点 B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量 D、称量空的小烧杯
E、将砝码放回砝码盒内 F、记录称量结果.
(4)配制Na2CO3溶液时需用的主要仪器有____________________
(5)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A、加水时越过刻度线_________ B、忘记将洗涤液加入容量瓶__________
C、容量瓶内壁附有水珠而未干燥处理______ D、溶解后没有冷却便进行定容_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应C(s) + CO2(g)![]() 2CO(g) △H>0,达到平衡状态,进行如下操作:
2CO(g) △H>0,达到平衡状态,进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④B.①③C.①②D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1D. v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业生产食品香精菠萝酯(![]() )的简易流程如图:
)的简易流程如图:
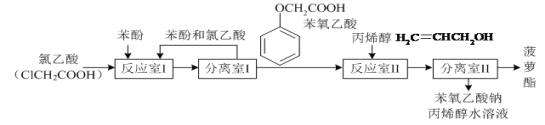
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用________(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热.
(2)分离室I采取的操作名称是__________。
(3)苯氧乙酸含氧官能团的名称__________。
(4)下列叙述错误的是_________。
A.反应室I产物中残留的苯酚可用FeCl3溶液检验
B.反应室Ⅱ产物中残留的丙烯醇可用溴水检验
C.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
D.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
(5)反应室I中发生反应的化学方程式是______。
(6)分离室Ⅱ的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是_______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.7.8g苯所含碳碳双键数目为0.3NAB.28g乙烯所含共用电子对数目为5NA
C.标准状况下,11.2L乙醇所含分子数为0.5NAD.16g甲烷电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com