
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:填空题
(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
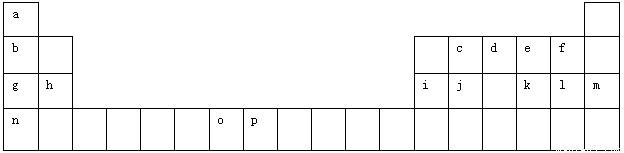
试回答下列问题:
(1)元素p的原子的电子占有 种能量不同的原子轨道。
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为 (用离子符号表示)。
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为______________,该分子是______(填“极性”或“非极性”)分子。
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____________。
(5)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____________________________________________________;
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为 ,含有的化学键为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高一3月月考化学试卷(解析版) 题型:选择题
下列各组物质中,括号内为杂质,其中除杂方法不正确的是
A.Na2CO3固体(NaHCO3) 加热 B.I2(砂子) 加热
C.Na2O2(Na2O) 氧气中加热 D.Cl2(HCl) 通过NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物既能与强酸反应又能与强碱反应
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q>L
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.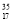 Cl与
Cl与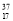 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:实验题
(15分)已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
实验 1 | 实验步骤 | 实验现象 |
ⅰ.取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ.溶液呈棕黄色。 | |
ⅱ.向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ.溶液不显红色。 |
①写出FeCl3溶液与KI溶液反应的离子方程式 。
②加入KSCN溶液的目的是 。
③甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2。
实验 2 | 实验步骤 | 实验现象 |
ⅰ.取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ.溶液呈棕黄色。 | |
ⅱ.向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ.溶液显红色。 | |
ⅲ.继续加入2 mL CCl4,充分振荡、静置。 | ⅲ.液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是 。用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因: 。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I- I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
①为验证假设,乙同学设计并完成了实验3。
实验3 | 实验步骤 | 实验现象 |
ⅰ.取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ.液体分层,上层呈黄色,下层呈紫红色。 | |
ⅱ.取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ.液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是 。
②甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I- I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中 。
两支试管中的现象分别为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:选择题
下列解释事实的方程式正确的是
A.在空气中切开金属钠,光亮表面变暗:2Na+O2===Na2O2
B.向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3+ + 3OH-===Al(OH)3↓
C.将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)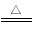 Fe2O3+3H2
Fe2O3+3H2
D.电解饱和氯化钠溶液,产生气体:2NaCl+2H2O  2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期二模考试理综化学试卷(解析版) 题型:填空题
〔化学—选修3:物质结构与性质〕(15分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32 -离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如图所示,该化合物的化学式为 。

纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三4月模拟练习化学试卷(解析版) 题型:选择题
下列实验操作中有错误的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出
D.蒸发操作时,应使混合物中的水分完全蒸干后,再停止加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com