
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g) (I)
(1)反应(I)中氧化剂是_______。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____
_______________________________________________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1,假设溶液的体积是bL)
(每空2分,共14分)(1)N2O4 (2) a、d 不变 0.1
(3)NH4++H2O NH3·H2O+H+ 逆向
NH3·H2O+H+ 逆向 
【解析】
试题分析:(1)根据反应(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g)可知,(CH3)2NNH2中氮元素的化合价从-2价升高到0价,N2O4中氮元素的化合价从+4价降低到0价,因此氧化剂是N2O4。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。a、密度是混合气的质量和容器容积的比值,在反应过程中质量不变,但容器容积是变化的,因此当密度不再发生变化时可以说明反应达到平衡状态,a正确;b、对于具体的化学反应,反应热是恒定的,不能说明反应达到平衡状态,b不正确;c、反应物的正反应速率是逐渐减小的,而生成物的正反应速率是逐渐增大,所以c不正确;d、当反应物的转化率不再发生变化时,说明正逆反应速率相等,达到平衡状态,d正确,答案选ad;平衡常数只与温度有关系,所以此时平衡常数不变;反应3s后NO2的物质的量为0.6mol,则根据方程式可知,消耗N2O4的物质的量是0.3mol,其浓度是0.3mol÷1L=0.3mol/L,则0~3s内的平均反应速率v(N2O4)=0.3mol/L÷3s=0.1mol·L-1·s-1。
(3)NH3NO3溶于水电离出的NH4+水解,溶液显酸性,水解方程式为NH4++H2O NH3·H2O+H+;氨水是弱碱,电离出的OH-抑制水的电离,所以滴加氨水的过程中的水的电离平衡将逆向移动;溶液显中性,则根据电荷守恒可知c(NO3-)+c(OH-) =c(NH4+)+c(H+),因此 c(OH-)=c(H+)=10-7mol/L, c(NH4+)=c(NO3-)。根据氨水的电离平衡常数可知,溶液中
NH3·H2O+H+;氨水是弱碱,电离出的OH-抑制水的电离,所以滴加氨水的过程中的水的电离平衡将逆向移动;溶液显中性,则根据电荷守恒可知c(NO3-)+c(OH-) =c(NH4+)+c(H+),因此 c(OH-)=c(H+)=10-7mol/L, c(NH4+)=c(NO3-)。根据氨水的电离平衡常数可知,溶液中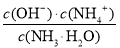 =2×10-5 mol·L-1,则c(NH3·H2O)=
=2×10-5 mol·L-1,则c(NH3·H2O)= =
=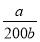 。
。
考点:考查氧化还原反应、平衡状态判断、反应速率计算以及盐类水解、电离平衡常数的计算


科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
A.水可以电离出离子,所以是强电解质
B.水的离子积可表示KW=c(H+)·c(OH-)
C.常温下水中的c(H+)大于c(OH-)
D.升高温度,c(H+)增大,显弱酸性
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s)  Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
A.溶液中钙离子数目减小 B.溶液中钙离子浓度减少
C.溶液中氢氧根离子浓度增大 D.pH减小
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-=4OH-
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe=Fe2++2e-
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s)  Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
A.溶液中钙离子数目减小 B.溶液中钙离子浓度减少
C.溶液中氢氧根离子浓度增大 D.pH减小
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
今有室温下四种溶液,有关叙述不正确的是
| ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.已知醋酸铵溶液呈中性,在①、②两中分别加入适量的氯化铵晶体或醋酸铵晶体后,两溶液的pH均减小
B.四种溶液分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4, 则Va ∶Vb=11∶9
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法或表示方法中,正确的是
A.等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多
B.a ℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g) ΔH=-2c kJ·mol-1
C.常温常压下,2.8 g CO气体完全燃烧放出的热量为28.26 kJ,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·mol-1
D.稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ·mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
等体积等物质的量浓度的一元碱 MOH 溶液和一元酸 HA 溶液混合后,下列离子浓度的关系不正确的是

查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
下列有机物检验方法正确的是
A.取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在
B.用酸性KMnO4溶液直接检验乙醇与浓硫酸反应是否得到乙烯
C.用燃烧的方法鉴别甲烷与乙炔
D.用新制CaO检验乙醇中是否含有水分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com