(2011?宝鸡一模)Ⅰ.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
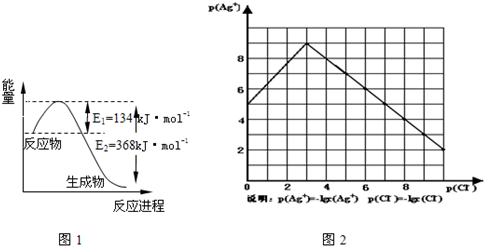
(1)图1是1mol NO
2和1mol CO反应生成CO
2和NO过程中能量变化示意图,请写出NO
2和 CO反应的热化学方程式
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ?mol-1
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N
2(g)+3H
2(g)?2NH
3(g)△H<0,其化学平衡常数K与温度t的关系如表:请完成下列问题;
①试比较K
1、K
2的大小,K
1>
>
K
2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是
c
c
(填序号字母)
a.容器内N
2、H
2、NH
3的浓度之比为1:3:2 b.υ(N
2)(正)=3υ(H
2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH
3(g)?N
2(g)+3H
2(g)的化学平衡常数的值为
2
2
.当测得NH
3和N
2、H
2的物质的量分别为3mol和2mol、1mol时,则该反应的
υ(N
2)(正)
>
>
υ(N
2)(逆) (填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl
-═[AgCl
2]
-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为
10-12
10-12
.
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-
Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag
2S),实验方案是
向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色
向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色
.
(4)若在AgCl形成的浊液中滴加氨水有什么现象?
白色沉淀溶解,形成无色溶液
白色沉淀溶解,形成无色溶液
.发生反应的离子方程式为
AgCl+2NH3=Ag(NH3)2++Cl-
AgCl+2NH3=Ag(NH3)2++Cl-
.

 [ ]
[ ] [ ]
[ ] [ ]
[ ] [ ]
[ ] 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案