
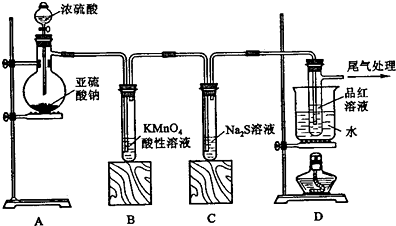
分析 (1)根据化学常用仪器及仪器的名称来分析;制备二氧化硫的方法是利用亚硫酸钠和浓硫酸反应生成;
(2)利用二氧化硫与高锰酸钾溶液,二氧化硫与硫化钠的氧化还原反应来分析反应现象和性质,二氧化硫具有还原性能还原高锰酸钾溶液,二氧化硫具有以下和-2价硫元素发生归中反应;
(3)高锰酸钾溶液和二氧化硫气体发生氧化还原反应,生成硫酸根离子、锰离子和谁,结合离子性质和电荷守恒,原子守恒配平书写离子方程式;
(4)根据二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色的检验方法分析;
(5)利用二氧化硫是还原性气体,属于酸性氧化物的性质来分析尾气处理.
解答 解:(1)装置A中盛放亚硫酸钠的仪器名称是蒸馏烧瓶,利用亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
故答案为:蒸馏烧瓶;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,二氧化硫进入硫化钠溶液中发生的氧化还原反应为2S2-+SO2+2H2O=3S↓+4OH-,则观察到出现黄色浑浊,B中S元素的化合价升高,表现还原性,C中二氧化硫中硫元素的化合价降低,表现氧化性,
故答案为:溶液由紫红色变为无色;无色溶液中出现淡黄色浑浊;还原性;氧化性;
(3)高锰酸钾溶液和二氧化硫气体发生的离子反应为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;
故答案为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;
(4)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,
故答案为:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(5)因浓硫酸不与二氧化硫反应,则不能处理尾气,abd都能与二氧化硫反应,但d碱性太弱,吸收效果不好,则利用ab的溶液来吸收尾气,
利用氢氧化钠溶液来吸收尾气,发生的离子反应为SO2+2OH-=SO32-+H2O,
利用高锰酸钾溶液来吸收尾气发生的离子反应为2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,
故答案为:ab.
点评 本题考查了二氧化硫的制取及二氧化硫的性质实验,题目难度中等,明确反应原理、二氧化硫的性质是解答本题的关键,注意掌握二氧化硫的性质及性质实验方案设计方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
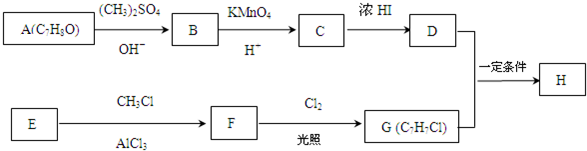
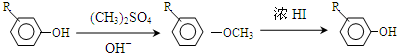
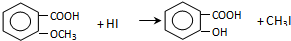 .
.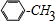 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$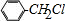 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.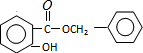 .
. (或
(或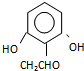 .
.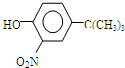
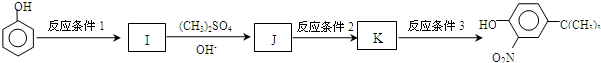
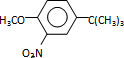 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1molC2H4所含的电子数为12 NA | |
| B. | 标准状况下,16g甲烷中共价键数目为4NA | |
| C. | 常温常压,4 g氦气所含的核外电子数为4NA | |
| D. | 标准状况下,22.4L NO 与11.2L O2 充分反应后,所得的气体分子数一定为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
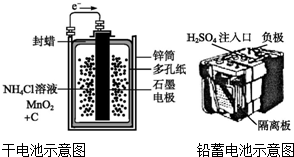
| A. | 上述电池分别属于一次电池、二次电池 | |
| B. | 干电池在长时间使用后,锌筒被破坏 | |
| C. | 铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g | |
| D. | 铅蓄电池负极材料为Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
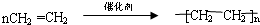 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com