
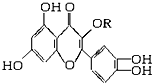
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1mol该物质可与5molNaOH发生反应 | |
| B. | 1mol该物质与足量溴水反应,最多消耗6molBr2 | |
| C. | 一定条件下1mol该物质可与H2加成,消耗H2最大量为6mol | |
| D. | 维生素P能发生水解反应 |
分析 由结构可知,分子中含酚-OH、碳碳双键、羰基、醚键等,结合酚、烯烃等有机物的性质来解答.
解答 解:A.只有4个酚-OH与NaOH反应,则与NaOH溶液反应,1 mol该物质可与4mol NaOH反应,故A错误;
B.酚-OH的邻对位与溴水发生取代反应,碳碳双键与溴水发生加成反应,则与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2,故B正确;
C.苯环、双键、羰基均与氢气发生加成反应,一定条件下1 mol该物质可与H2加成,耗H2最大量为8 mol,故C错误;
D.不含-COOC-、-CONH-、-X等,则不能发生水解反应,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、烯烃、苯的性质及分析与应用能力的考查,选项D为解答的难点,题目难度不大.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:填空题
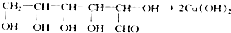 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$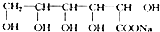 +Cu2O+3H2O.实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯、胶头滴管外,还需要漏斗、玻璃棒
+Cu2O+3H2O.实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯、胶头滴管外,还需要漏斗、玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | C( F-)<C(CN-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
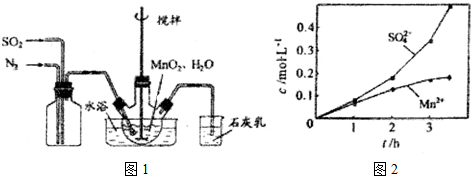
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000mL 50.0g | B. | 950mL 47.5g | C. | 950mL 30.4g | D. | 1000mL 32.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
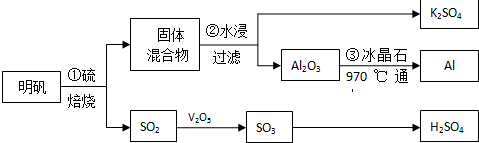
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:2 | C. | 2:5 | D. | 5:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com