
某分子式为C10H20O2的酯,在一定条件下可发生如下图所示的转化过程:则符合上述条件的酯的结构可有( )
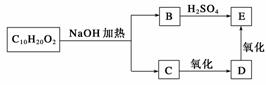
A.2种 B.4种 C.6种 D.8种
科目:高中化学 来源: 题型:
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下 ,该同学得出的结论正确的是( )
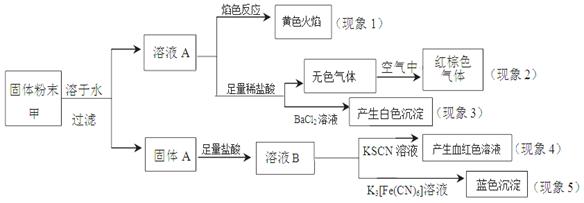
A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素
B.根据现象2可推出该固体粉末中一定含有NaNO2
C.根据现象3可推出该固体粉末中一定含有Na2SO4
D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室中制备气体或验证气体性质的装置图
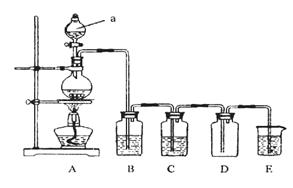
(1)写出用A制取氯气的化学方程式_________________________________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+
则装置B中的溶液的作用是___________________________________;
装置D中加的最佳试剂是(填序号)___________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的__________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为______________________;
实验2不严谨之处应如何改进________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色
B.有机物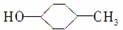 的消去产物有两种
的消去产物有两种
C.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是

D.可用溴水鉴别甲苯、苯酚、1己烯三种无色液体
D [甲苯只能使酸性高锰酸钾溶液褪色而不能使溴的四氯化碳溶液褪色;有机物有如下对称轴 ,其消去产物只有一种;有机物
,其消去产物只有一种;有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是含单官能团的化合物,A水解得B和C,B氧化可以得到C或D,D氧化也可得到C。若M(X)表示X的摩尔质量,则下列关系式正确的是( )
A.M(A)=M(B)+M(C)
B.2M(D)=M(B)+M(C)
C.2M(B)>M(D)+M(C)
D.M(D)<M(B)<M(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰干电池在放电时,电池总反应方程式可以表示为Zn+2MnO2+2NH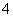 ===Zn2++Mn2O3+2NH3+H2O。在此电池放电时,正极(碳棒)上发生反应的物质是( )
===Zn2++Mn2O3+2NH3+H2O。在此电池放电时,正极(碳棒)上发生反应的物质是( )
A.MnO2和NH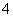 B.Zn2+和NH
B.Zn2+和NH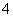
C.Zn D.碳棒
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验1、2中Al所作的电极是否相同?
________________________________________________________________________。
(2)指出铝和石墨的电极并写出实验3中的电极反应式和电池总反应方程式。
铝为( ):
________________________________________________________________________。
石墨为( ):
________________________________________________________________________。
电池总反应:
________________________________________________________________________。
(3)实验4中的铝作正极还是负极?________,为什么?
________________________________________________________________________
________________________________________________________________________。
(4)解释实验5中电流计指针偏向铝的原因:
________________________________________________________________________
________________________________________________________________________。
(5)根据实验结果总结:在原电池中金属铝作正极还是负极受到哪些因素的影响?________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
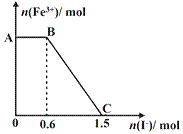
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I- =2Fe2++I2
C.若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则有蓝色沉淀生成
D.开始加入的K2Cr2O7为0.25 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com