
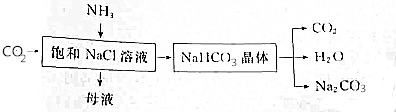
分析 (1)碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;盐是由金属离子和酸根离子组成的化合物;纯净物由一种物质组成,混合物由两种或两种以上的物质组成;电解质是指:在水溶液中或熔融状态下能够导电的化合物;
(2)反应流程:氨气极易溶于水,二氧化碳在水中的溶解度较小,向氨化的饱和食盐水中通入二氧化碳气体析出碳酸氢钠,碳酸氢钠受热分解制得碳酸钠;
①氨气、水、二氧化碳反应生成碳酸氢钠、氯化铵;
②母液中含有铵根离子、氯离子;
③根据除杂原则,不能引入新的杂质;
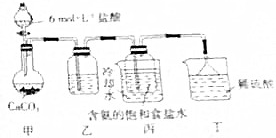
(3)①依据制取二氧化碳时常会含有氯化氢气体,选择能和氯化氢反应但是不和二氧化碳反应的物质来除杂即可;
②依据稀硫酸能与氨气反应,氨气有毒易造成污染分析解答;
③稀硫酸代替稀盐酸,生成微溶的硫酸钙,反应速率减慢.
解答 解:(1)纯碱是碳酸钠的俗称,是由钠离子和碳酸根组成的化合物,属于盐,
故选b;
(2)①工业上以NaCl、NH3、CO2等为原料,先制得NaHCO3,进而生产出纯碱,氨气、水、二氧化碳反应生成碳酸氢钠,反应为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,
故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
②依据NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl可知母液中除了氨水电离出的氢氧根离子还有氯化铵电离出的铵根离子、氯离子,
故答案为:NH4+、Cl-;
③a.加适量NaOH,虽能将碳酸氢钠反应生成碳酸钠,但控制加入的氢氧化钠恰好不易控制,故不选;
b.加适量盐酸,盐酸和碳酸钠、碳酸氢钠都反应,故不选;
c.暴露于空气一段时间,碳酸钠会部分转化为碳酸氢钠,故不选;
d.加热至质量不再减少,碳酸钠受热分解生成碳酸钠、水、二氧化碳,能除去碳酸钠中的碳酸氢钠,故选;
故答案为:d;
(3)①利用盐酸制取二氧化碳时二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应,所以通过饱和碳酸氢钠的溶液是为了除掉气体中的氯化氢气体,
故答案为:饱和碳酸氢钠溶液;
②实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,防止造成污染,
故答案为:吸收丙中逸出的NH3,防止污染空气;
③稀硫酸与块状石灰石反应生成微溶于水的硫酸钙,会覆盖在石灰石表面,阻止反应的进行,
故答案为:生成硫酸钙微溶,覆盖在碳酸钙表面阻止反应进一步进行.
点评 本题考查了工业制纯碱的流程和原理,此题是一道实验探究综合题,充分的展示了化学知识的方方面面,该题综合性强,对训练学生良好地思维品质以及知识的严密性有较好的帮助,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于足量稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3(胶体)+CO32- | |
| D. | 氯气与水反应:Cl2+H2O=2H++ClO-+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+m}$(Z+m)mol 质子 | B. | $\frac{a}{A}$(Z+m)mol 电子 | ||
| C. | $\frac{a}{A+m}$(A-Z+m)mol 中子 | D. | $\frac{a}{A}$mmolHmX |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
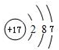 ,写出化合物E2B2的电子式
,写出化合物E2B2的电子式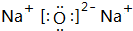 ,C在周期表中的位置第三周期VIA族.
,C在周期表中的位置第三周期VIA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-+BrO3-→IO3-+Br- | |
| B. | 6I-+BrO3-+6H+→3I2+Br-+3H2O | |
| C. | 5I-+6BrO3-+6H+→3Br2+5I03-+3H20 | |
| D. | 5I-+2BrO3-+6H+→Br2+I03-+2I2+3H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 杂质 | 加入的试剂 |
| 硫酸盐 | ①BaCl2 |
| MgCl2 | ②NaOH |
| CaCl2 | ③Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的简单离子半径大于W的简单离子半径 | |
| B. | Z的氧化物对应水化物为强酸 | |
| C. | 固体Y2Z3不能从溶液中制得 | |
| D. | XW2分子中各原子最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组为了探究甲烷和氯气反应的情况,请填空:
某研究小组为了探究甲烷和氯气反应的情况,请填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com