
【题目】硫有多种含氧酸,在工业上有广泛的应用,其钠盐同样也是重要的化工产品。
Ⅰ.硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置模拟生成过程:

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)烧瓶A中发生反应的离子方程式为_________________________________。装置D的作用是__________________________。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择_____________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有______
a.烧杯 b.燕发皿 c.试管 d.锥形瓶
(4)为了保证Na2S2O3的产量,实验中通入SO2不能过量,原因是_____________________。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。(Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3-电离程度大于水解程度,可采用的实验方法有________________。
a.测定溶液的pH b.加入Ba(OH)2溶液 c. .加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定菜葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI):
![]()
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为______g/L
②在上述实验过程中,HI可能会被空气氧化,反应的化学方程式为_____________________________。若有部分HI被空气氧化,会导致测得的结果_______(填“偏高”“ 偏低”或“不变”)。
【答案】 SO32-+2H+=H2O+SO2↑ 防止倒吸 c ad 若SO2过量,溶液显酸性,产物分解 ae 0.16 4HI+O2=2I2+2H2O 偏低
【解析】(1)烧瓶A中亚硫酸钠与硫酸反应生成二氧化硫、硫酸钠和水,其反应的离子方程式为:SO32-+2H+=H2O+SO2↑;D中左侧为短导管可防止液体倒吸,故答案为:SO32-+2H+=H2O+SO2↑;防止倒吸;
(2)观察SO2的生成速率,是通过观察溶液中产生气泡的快慢来判断,所以溶液不能与SO2反应,选项中只有饱和NaHSO3溶液与二氧化硫不反应,故答案为:c;
(3)体积较大的玻璃仪器在加热时,仪器下面要放石棉网,防止仪器受热不均而炸裂,其中烧杯、锥形瓶加热时必须使用石棉网,故答案为:ad;
(4)由题目信息可知,硫代硫酸钠(Na2S2O3)遇酸易分解,若二氧化硫过量会使溶液呈酸性,硫代硫酸钠会分解,故答案为:若SO2过量,溶液显酸性,产物分解;
(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae,故答案为:ae;
(6)令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以![]() =
=![]() ,解得m=0.016,故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
,解得m=0.016,故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为![]() =0.16 g/L,若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低;HI与氧气反应的化学方程式为:4HI+O2=2I2+2H2O,故答案为:0.16;偏低;4HI+O2=2I2+2H2O。
=0.16 g/L,若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低;HI与氧气反应的化学方程式为:4HI+O2=2I2+2H2O,故答案为:0.16;偏低;4HI+O2=2I2+2H2O。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 60gSiO2晶体中含有4NA条硅氧键
B. 1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有的OH-离子数为0.1 NA
D. K35ClO3与浓H37Cl反应制得7.2gCl2,则生成的Cl2分子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学提出了下列环保建议,其中你认为可以采纳的是( )
①用气态燃料代替液态和固态燃料作为发动机动力来源;②开发生产无汞电池;③提倡使用一次性发泡塑料餐具和塑料袋;④分类回收垃圾;⑤开发无磷洗涤剂;⑥提倡使用手帕,减少餐巾纸的使用
A. ①②③④ B. ②③④⑤
C. ①②④⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、N三种元素在人体的化学成分中,质量分数共占73%左右,而在岩石圈的化学成分中,质量分数不到1%,这一事实说明( )
A. 生物界与非生物界具有相似性
B. 生物界与非生物界具有统一性
C. 生物界与非生物界具有差异性
D. 生物界和非生物界的本质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
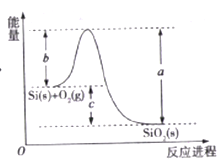
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内虽很少,却是维持正常生命活动不可缺少的,这可以通过下面哪一实例得到说明
A. Mg是叶绿素的组成成分 B. 油菜缺少硼时会出现“花而不实”
C. 动物血液钙盐含量太低会抽搐 D. 缺P会影响ATP的合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com