
| A. | 彩色密封塑胶袋能造成白色污染 | |
| B. | 钠、氧化钠、氢氧化钠都能与醋酸反应得到醋酸钠 | |
| C. | 化学变化都伴随着能量的变化 | |
| D. | 大多数合金比各成分金属硬度小,熔点低 |
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 16g氧气所含的氧原子数为2NA | |
| B. | 18g水所含的电子数为NA | |
| C. | 2.4g金属镁与盐酸(足量)反应失去的电子数为0.1NA | |
| D. | 17g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
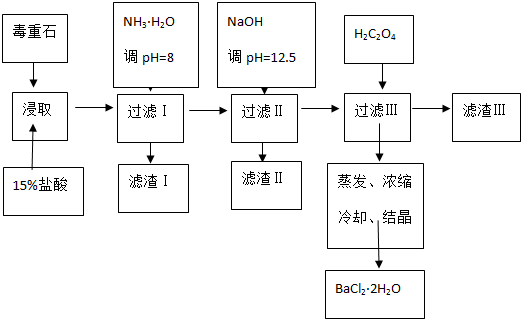
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②④ | C. | ②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
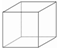 ,其六氯代物有3种;
,其六氯代物有3种;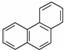 ,其二氯代物的数目为25种;
,其二氯代物的数目为25种;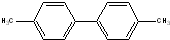 ),其二氯代物有16种.
),其二氯代物有16种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
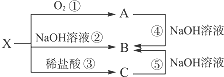 已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=1的溶液中:K+、Fe2+、ClO-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液:Cu2+、Na+、SO42-、NO3- | |
| C. | 加入铝粉产生大量氢气的溶液中:Na+、NH4+、NO3-、SO42- | |
| D. | 在0.1 mol•L-1 Fe3+溶液中:K+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入醋酸钠固体,可抑制醋酸的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油在上层,水在下层,汽油层呈无色 | |
| B. | 汽油在下层,水在上层,汽油层呈紫色 | |
| C. | 汽油在上层,水在下层,水层呈无色 | |
| D. | 汽油在上层,水在下层,水层呈紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com