
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g) △H1
C(s)+ 1/2 O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H3
S(g)+O2(g)=SO2(g) △H4
③H2(g)+1/2O2(g)=H2O(l) △H5
2H2(g)+O2(g)=2H2O(l) △H6
④CaCO3(s)=CaO(s)+CO2(g) △H7
CaO(s)+H2O(l)=Ca(OH)2(s) △H8
A.①③④ B.②③④ C.①②④ D.①②③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:填空题
锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
⑴Ga的原子结构示意图为 ___________________。
⑵GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式 。
⑶下列有关镓和镓的化合物的说法正确的是____ 。
A.常温下,Ga可与水剧烈反应放出氢气
B.一定条件下,Ga可溶于盐酸和氢氧化钠
C.一定条件下,Ga2O3可与NaOH反应生成盐
D.Ga2O3可由Ga(OH)3受热分解得到
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
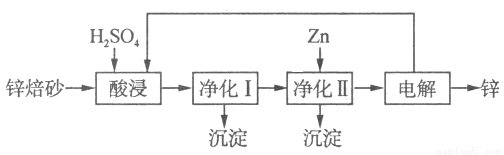
已知:Fe的活泼性强于Ni
⑷ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为 。
⑸净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
⑹净化II中加入Zn的目的是___________________。
⑺常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3] = 8.0 × 10-38;lg5 = 0.7
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:实验题
已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO + 2Cu(OH)2 + NaOH  CH3COONa + Cu2O↓+ 3H2O
CH3COONa + Cu2O↓+ 3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL[ | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 m L
L
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知 :Cu2O在碱性条件下稳定
:Cu2O在碱性条件下稳定 ,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实 验步骤是 。
验步骤是 。
基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
下列关于物质或离子检验的叙述正确的是( )
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:填空题
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
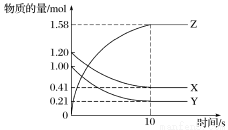
(1)从反应开始到10 s时,用Y表示的反应速率为____________________。
(2)该反应的化学方程式为_______________________。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:
甲:v(X)=0.3 mol·L-1·s-1;
乙:v(Y)=0.12 mol·L-1·s-1
丙:v(Z)=9.6 mol·L-1·min-1;
则甲、乙、丙三个容器中反应速率由慢到快的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol,
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)=3N2(g) +4H2O(g) ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3 kJ/mol
C.N2H4(g)+ N2O4(g)=
N2O4(g)= N2(g)+2H2O(g) ΔH=-1076.7 kJ/mol
N2(g)+2H2O(g) ΔH=-1076.7 kJ/mol
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
下列与化学反应能量变化相关的说法不正确的是
A.任何化学反应都伴随着热量的变化
B.一个反应是吸热反应还是放热反应要看反应物和生成物具有总能量的相对大小
C.化学键的断裂一定吸收能量, 化学键的形成一定释放能量
D.化学反应过程的能量变化除热能外,也可以是光能、电能等
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
根据热化学方程式:S(g)+O2(g) SO2(g) ΔH=-Q kJ·mol-1,下列分析正确的是( )
A.1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ
B.1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出Q kJ的热量
C.S(s)+O2(g)=SO2(g) ΔH <-Q kJ·mol-1
D.1个S(g)与1个O2(g)完全反应可以放出Q kJ的热量
查看答案和解析>>
科目:高中化学 来源:2017届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
下图所示装置中,已知电子由b极沿导线流向锌。下列判断正确的是 ( )
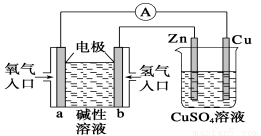
A.该装置中Cu极为阳极
B.一段时间后锌片质量减少
C.b极反应的电极反应式为H2-2e-+2OH-===2H2O
D.当铜极的质量变化为32 g时,a极上消耗的O2的体积为5.6 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com