
分析 (1)根据生成氨气的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的氮气的物质的量,t时刻时氮气的物质的量与参加反应的氮气的物质的量之和为a的值;
(2)计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量;
(3)原混合气体的物质的量减去氮气的物质的量为氢气的物质的量,据此计算;
(4)计算出达到平衡时,N2和H2的转化率,据此计算.
解答 解:(1)反应进行到t时,测的N2为3mol,NH3为6mol,由方程式可知,参加反应的氮气的物质的量为6mol×$\frac{1}{2}$=3mol,故氮气的起始物质的量为:13mol+3mol=16mol,即a=16,故答案为:16;
(2)反应达平衡时,混合气体$\frac{716.8L}{22.4L/mol}$=32mol,其中NH3的物质的量为32mol×25%=8mol.
故答案为:8mol;
(3)利用差量法计算:
N2 (g)+3H2(g) 2NH3(g),物质的量减少△n
2NH3(g),物质的量减少△n
1mol 3mol 2mol 2mol
转化:4mol 12mol 8mol 8mol
故原混合气体为32mol+8mol=40mol,由(1)知a=16mol,则b=40mol-16mol=24mol,
反应达平衡时,混合气体的体积为716.8L(标准状况下),$\frac{716.8L}{22.4L/mol}$=32mol,原混合气体与平衡混合气体的压强之比等于混合气体物质的量之比,即p(始):p(平)=(a+b):32=40mol:32mol=5:4,
故答案为:5:4;
(4)达到平衡时,N2和H2的转化率之比α(H2):α(N2)=$\frac{16mol}{4mol}$:$\frac{24mol}{12mol}$=2:1.
故答案为:2:1.
点评 本题考查化学平衡的计算,题目难度不大,注意利用三段式法结合化学方程式计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
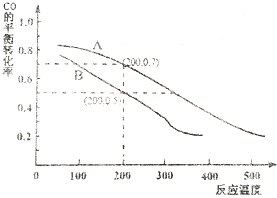
| A. | 保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7 mol | |
| D. | CO的平衡转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | CCl4可用于鉴别溴水和碘水 | |
| C. | 漂白粉在空气中不稳定,因此可用于漂白纸张 | |
| D. | 用乙醇萃取的方法可以分离溶于水的碘,是因为碘在乙醇中的溶解度较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌做负极发生氧化反应 | |
| B. | 供电时的总反应为:Zn+2H+═Zn2++H2↑ | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 产生1 g H2,消耗锌的质量65 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加KSCN溶液,变为血红色,则原溶液中含有Fe3+ | |
| B. | 向某溶液中滴加NaOH溶液,生成白色沉淀,继而变为灰绿色,最终变为红褐色,则原溶液中含有Fe2+ | |
| C. | 将淀粉和氯化钠的混合溶液装入半透膜中,将半透膜浸泡在盛有蒸馏水的烧杯中,为检验半透膜是否破损,可向蒸馏水中加入硝酸银溶液来验证 | |
| D. | 硫酸亚铁溶液中,常放入一些铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0 mol | B. | 1.5mol | C. | 1.0mol | D. | 0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
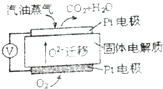
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com