
【题目】酸雨形成的过程之一可表示如下:

请回答下列问题。
(1)A的化学式为_______,B的化学式为_______。
(2)三个反应中,不属于氧化还原反应的是_______(填序号)。
(3)![]() 中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的_______(填“氧化剂”或“还原剂”)除去
中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的_______(填“氧化剂”或“还原剂”)除去![]() ,达到减少污染的目的。
,达到减少污染的目的。
(4)雨水的pH小于5.6时,就判定为酸雨。已知![]() ,经测定某次雨水所含酸性物质只有
,经测定某次雨水所含酸性物质只有![]() ,且其浓度为
,且其浓度为![]() ,则这次降雨________(填“是”或“不是”)酸雨。
,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有![]() 、
、![]() 等。为了除去有害的
等。为了除去有害的![]() 气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面
气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面![]() 的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的
的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的![]() 增加了35%,但由于高烟囱的建造,地面
增加了35%,但由于高烟囱的建造,地面![]() 浓度降低了30%之多。
浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是________________(填序号)。
A.少用煤作燃料 B.把工厂的烟囱建高 C.燃料脱硫 D.把工厂迁移到农村 E.开发新能源
②请从全球环境保护的角度分析这种建高烟囱的方法是否可取?______(填“可取”或“不可取”),理由是_______________________________________________________________________。
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.σ键比π键的电子云重叠程度大,形成的共价键强
B.s-sσ键与s-pσ键的电子云形状对称性相同
C.丙烯(CH3—CH=CH2)分子有8个σ键,1个π键,其中碳原子分别是sp2、sp3杂化
D.N2分子中有一个σ键,2个π键;NH4+中4个N-H键的键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A有下列变化:
的有机物A有下列变化:

其中B、C的相对分子质量相等,下列有关说法错误的是( )
A.C和E互为同系物
B.符合题目条件的A共有4种
C.D既能发生氧化反应,又能发生还原反应
D.符合题目条件的B共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | A的相对分子质量为:___。 |
(2)将此4.5gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g。 | A的分子式为:___。 |
(3)另取A4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2(标准状况),若与足量金属钠反应则生成1.12LH2(标准状况)。 | 写出A中含有的官能团___、__。 |
(4)A的核磁共振氢谱如图: | 综上所述,A的结构简式为___。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置_______。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
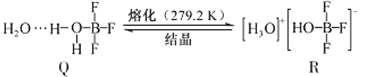
①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚(![]() )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前生产聚氯乙烯的方法是先使乙烯与氯气和氧气在一定条件下反应生成氯乙烯和水,再进一步合成聚氯乙烯。请回答
(1)请写出上述两个过程所发生反应的化学方程式:①____________________________,②__________________________________________。
(2)聚氯乙烯是一种可燃物,火灾中聚氯乙烯燃烧会产生有害气体,其主要成分可能是_________;若在火灾现场,为了防止气体中毒,应采取的防护措施是__________________________________________。
(3)聚氯乙烯___________(填“可以”或“不可以”)用于制作食品包装袋,原因是______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1 molL-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图。下列说法不正确的是

A. A、B、C三点所表示的溶液中水的电离程度依次增大
B. 加入1 mol NaOH后,溶液中c(Na+)=c(R-)
C. 通入HCl, R-的水解程度增大,HR的电离常数减小
D. 未加HCl和NaOH时,溶液中c(R-)>c(Na+)>c(HR)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两对未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对的电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号________,该能层具有的原子轨道数为_________。
(2)E2+离子的价层电子排布图是__________,F原子的电子排布式是__________。
(3)A元素的最高价氧化物对应的水化物中心原子采用的轨道杂化方式为______,B元素的气态氢化物的VSEPR模型为___________。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们的结构相似,DAB-的电子式为_____________
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为________________________
(6)某种化合物由D、E、F三种元素组成,其晶胞如图所示,其化学式为_____。
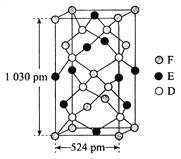
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com