
| A. | 20gD2O所含电子数为10NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 1molNa被氧化成Na2O2,失去电子数目为2NA | |
| D. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键总数为2NA |
分析 A.重水的摩尔质量为20g/mol,含10个电子;
B.溶液体积不明确;
C.钠反应后变为+1价;
D.当反应生成2molHCl时,断裂2mol化学键.
解答 解:A.重水的摩尔质量为20g/mol,含10个电子,故20g重水的物质的量为1mol,故含10mol电子即10NA个,故A正确;
B.溶液体积不明确,故溶液中氢氧根的个数无法计算,故B错误;
C.钠反应后变为+1价,故1mol钠失去1mol电子即NA个,故C错误;
D.当反应生成2molHCl时,断裂2mol化学键,故当生成标况下22.4LHCl即1molHCl时,断裂1mol化学键即NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤⑦ | D. | ①④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
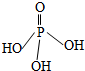 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na5P3O10 | |
| C. | 以磷酸钠为原料通过化合反应也能生成三聚磷酸钠 | |
| D. | 多聚磷酸的结构可表示为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取硝基苯 | |
| B. | 实验室制取溴苯 | |
| C. | 溴乙烷的消去反应 CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH2═CH2↑+NaBr+H2O | |
| D. | 制取TNT |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
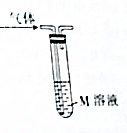 利用如图所示装置和对应试剂不能达到相应实验目的是( )
利用如图所示装置和对应试剂不能达到相应实验目的是( ) | 选项 | 实验目的 | M溶液 | 现象 |
| A | 检验乙烷中含有的乙烯 | 酸性高锰酸钾溶液 | 溶液颜色变浅 |
| B | 检验工业合成氨混合气体中的NH3 | 酚酞溶液 | 溶液变红 |
| C | 检验CO2中含有的SO2 | 品红溶液 | 溶液褪色 |
| D | 检验Cl2中含有的HCl | 硝酸银溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取Cu(NO3)•3H2O于烧杯中,加入适量蒸馏水使其溶解得蓝色澄清溶液 | |
| B. | 把Na2CO3白色粉末加入Cu(NO3)•3H2O溶液中,同时加热促进反应 | |
| C. | 搅拌反应体系一段时间后析出大量绿色沉淀 | |
| D. | 将反应混合物过滤得绿色固体产品,用蒸馏水洗三次,烘干既得产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
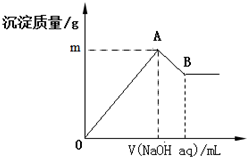 在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )
在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )| A. | a的取值范围是0<a<$\frac{1}{15}$ | |
| B. | 图中m的取值范围5.2~5.8 | |
| C. | A、B两点横坐标的数值均随x变化而变化 | |
| D. | 若B点横坐标数值为120,则a=0.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3 溶液加入到1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN 溶液 | 溶液变红 |

| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com