
分析 A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,结合原子结构以及元素对应的单质、化合物的性质可解答该题.
解答 解:A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素.
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,
氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2 AlO2-+H2O,
故答案为:第三周期第ⅢA族;Al2O3+2OH-=2 AlO2-+H2O;
(2)由H、C、O三种元素组成的18电子微粒,该微粒中只能含有1个C原子、1个O原子,故含有H原子数目=18-6-8=4,故该微粒结构简式为CH3OH,
故答案为:CH3OH;
(3)A2W2为H2O2,是二元弱酸,以第一步电离为主,则电离方程式为H2O2?HO2-+H+,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2,
故答案为:H2O2?HO2-+H+;BaO2+H2SO4=BaSO4↓+H2O2;
(4)Cu和稀硫酸不反应,加入具有氧化性的H2O2,可生成硫酸铜和水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O,
故答案为:Cu+2H++H2O2=Cu2++2H2O;
(5)NaH+H2O=NaOH+H2↑
1mol 1mol 1mol
2NaOH+2Al+2H2O=2NaAlO2+3H2↑,
1mol 1mol 1.5mol
n(H2)=1mol+1.5mol=2.5mol,
V(H2)=2.5mol×22.4L/mol=56L,
故答案为:56.
点评 本题考查元素的推断和元素化合物知识,难度中等,注重于元素化合物的考查,(5)中关键是明确NaH与水的反应,再利用方程式计算解答.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 目的 |
| A | 取4gNaOH固体溶入100mL水中 | 配制4mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1~2mLFeCl3饱和溶液,搅拌并继续煮沸出现浑浊 | 制备Fe(OH)3胶体 |
| C | 测定等物质的量浓度的盐酸、硝酸的pH | 比较Cl、N的非金属性强弱 |
| D | 用熔融氧化铝、CCl4做导电性实验 | 验证两者是离子化合物还是共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
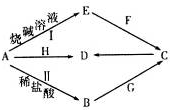
 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.| O=O(g) | H-H(g) | H-O(g) | |
| 键能/kJ•mol-1 | 496 | x | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和FeCl3溶液,溶液呈红褐色:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HS03- | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 向明矾溶液中滴加少量Ba(OH)2:2Al3++3SO4 2-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 反应②的条件是氢氧化钠水溶液、加热
反应②的条件是氢氧化钠水溶液、加热

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦ | B. | ②③ | C. | ③⑤ | D. | ②⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com