
| ||
| ||


科目:高中化学 来源: 题型:
A、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O | ||||
| C、NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | ||||
| D、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的Na2CO3和NaHCO3与足量的盐酸反应,在相同条件下NaHCO3产生的CO2气体体积大 |
| B、同一温度下,与等浓度的盐酸反应时,NaHCO3比Na2CO3剧烈 |
| C、与同种酸反应生成等量的CO2时,所消耗的酸的量相等 |
| D、将石灰水加入到NaHCO3溶液中将会产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去HNO3溶液中的少量H2SO4,可加适量BaCl2溶液 |
| B、除去铝粉中的少量铁粉,可加适量盐酸 |
| C、除去FeCl3溶液中的少量FeCl2,可加适量氯水 |
| D、除去NH4NO3固体中的少量NH4Cl,可加适量NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液 | 用化学用语表示溶液呈酸性(或碱性)的原因 |
| Fe2(SO4)3溶液 | |
| Na2CO3溶液 | |
| NaHSO4溶液 | |
| 等物质的量醋酸和醋酸钠的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
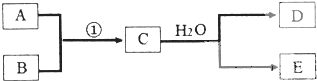 已知物质A、B、C、D、E是由短周期元素构成的单质或化合物,它们可发生如图所示的转化关系:
已知物质A、B、C、D、E是由短周期元素构成的单质或化合物,它们可发生如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温、高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W、Y、Z的非金属性大小顺序一定是Z>Y>W |
| B、W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z |
| C、Y、Z形成的分子空间构型可能是正四面体 |
| D、XZ3中含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com