
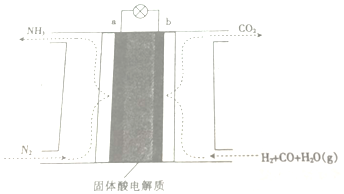
| A. | 放电时,b极表面H2与CO均被氧化 | |
| B. | 该电池工作时,H+由b极区迁移至a极区 | |
| C. | a极的电极反应为N2+6H++6e-=2NH3 | |
| D. | 工作一段时间后b极附近的PH增大 |
分析 A、b极表面H2与CO中氢和碳元素的化合价均升高;
B、原电池中阳离子向正极移动;
C、a极是正极,发生还原反应;
D、b极区产生大量的氢离子.
解答 解:A、b极表面H2与CO中氢和碳元素的化合价均升高,所以b极表面H2与CO均被氧化,故A正确;
B、原电池中阳离子向正极移动,b是负极,而a是正极,所以H+由b极区迁移至a极区,故B正确;
C、a极是正极,发生还原反应,电极反应式为:N2+6H++6e-=2NH3,故C正确;
D、b极区产生大量的氢离子,所以工作一段时间后b极附近的PH减小,故D错误;
故选D.
点评 本题考查化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钠投入到氯化镁溶液中:2Na+Mg2+═Mg+2 Na+ | |
| B. | 把金属钠放入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 将氯水加入碘化钾溶液中:Cl2+2I-═2Cl-+I2 | |
| D. | 盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
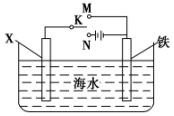 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电过程中Li+向正极移动 | |
| B. | 可加入硫酸以提高电解质的导电性 | |
| C. | 充电时,Li+向阳极移动 | |
| D. | 放电时,负极反应式为:2Li0.35NiO2+Li++e-═2Li0.85NiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y、R的简单离子半径依次增大 | |
| B. | X、R、Z都可与Y形成两种化合物 | |
| C. | X2Y的热稳定性强于X2R、沸点也高于X2R,但解释的理由不相同 | |
| D. | Z元素分别与X元素和Y元素形成的化合物都是离子晶体,均能与水反应且一定生成了强碱和无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑤⑥⑦ | C. | ③④⑥⑦ | D. | ②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
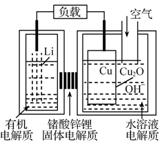 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )| A. | 电池放电时,正极附近溶液pH增大 | |
| B. | 工作时,Li+透过固体电解质向Cu极移动 | |
| C. | 电池放电过程中,空气中的O2并不参加反应 | |
| D. | 两极的有机电解质和水溶液电解质不可对换 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com