
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
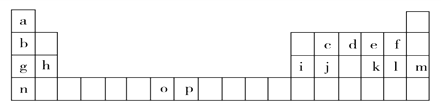
(1)基态o原子的外围电子排布图______________;基态p3+的最外层电子排布式_________;n的原子结构示意图__________。基态j原子的核外电子填充时最高能级符号为_______。
在以上元素中,没有未成对电子的元素有______种。
(2)原子序数为52的元素x在元素周期表中与以上______________元素在同一族(填写以上表中字母对应的元素符号)。
(3)上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p),则I3(o)__I3(p)(填“>”或“<”)。理由是_____________________________。
(4)将以上周期表中g、h、i、j四种元素的电负性由大到小排序____________________(用元素符号表示),第一电离能由大到小排序______________(用元素符号表示)。
【答案】 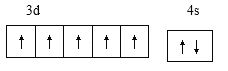 3s23p63d5
3s23p63d5  3p 2 O或S
3p 2 O或S ![]() Mn2+的3d轨道电子排布为半充满状态,比较稳定 Si> Al > Mg >Na Si>Mg>Al>Na
Mn2+的3d轨道电子排布为半充满状态,比较稳定 Si> Al > Mg >Na Si>Mg>Al>Na
【解析】根据元素周期表知,a-p各元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn 、Fe。
(1)基态o原子为锰,核电荷数为25,,[Ar]3d54s2,外围电子排布图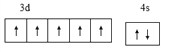 ;基态p3+ 为Fe3+,最外层电子排布式3s23p63d5 ;n原子为钾,核电荷数19,原子结构示意图
;基态p3+ 为Fe3+,最外层电子排布式3s23p63d5 ;n原子为钾,核电荷数19,原子结构示意图 ;j原子为硅,电子排布为1s22s22p63s23p2,核外电子填充时最高能级符号为3p;在以上元素中,没有未成对电子的元素有Mg、Ar两种元素,共计2种;正确答案:
;j原子为硅,电子排布为1s22s22p63s23p2,核外电子填充时最高能级符号为3p;在以上元素中,没有未成对电子的元素有Mg、Ar两种元素,共计2种;正确答案: 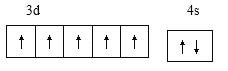 ;3s23p63d5 ;
;3s23p63d5 ;  ; 3p;2。
; 3p;2。
(2)稀有气体氙,原子序数为54,位于0族,依次前推,53号元素为碘,52号元素锑,位于VIA族,与O或S同族,正确答案:O或S。
(3)o、p分别表示锰和铁元素,由于Mn2+的3d轨道电子排布为半充满状态,比较稳定,所以第三电离能分别为I3(o) ![]() I3(p);正确答案:
I3(p);正确答案:![]() ;Mn2+的3d轨道电子排布为半充满状态,比较稳定。
;Mn2+的3d轨道电子排布为半充满状态,比较稳定。
(4)g、h、i、j四种元素分别为钠、镁、铝、硅,同一周期从左到右电负性增大,因此电负性由大到小排序:Si> Al > Mg >Na;同一周期第一电离能从左到右增大,但是IIA、 VA电离能大于邻近元素的电离能,因此第一电离能由大到小排序Si>Mg>Al>Na;正确答案:Si> Al > Mg >Na;Si>Mg>Al>Na。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】能发生离子反应,但不会产生沉淀的是
A. 澄清石灰水中通入CO2 B. NaHCO3溶液中滴加NaOH溶液
C. Na2CO3溶液中滴加NaOH溶液 D. 氯化钠溶液中滴加硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)联氨是一种可燃性液体,可用作火箭燃料。已知32.0gN2H4和H2O2反应生成氮气和水(气态),放出热量642kJ,该反应的热化学方程式是:____________。
(2)取300mL0.2mo/L的KI溶液与一定量的KMnO4溶液恰好反应,生成等物质的量I2和KIO3,则消耗KMnO4的物质的量是__________mol。
(3)以甲醇(CH3OH) 为燃料的电池中,电解质溶液为碱性,则负极的电极反应为:__________。
(4)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2) 固体制备二氧化氯的方法,其化学方程式为___________。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是__________,又变为棕黄色的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲快速制取H2,应选用正确的措施是
A.纯锌与稀硫酸反应B.将浸泡过CuS04溶液的Zn跟稀硫酸反应
C.粗锌跟硝酸反应D.粗锌跟浓硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是

A. Y、R两种元素的气态氢化物稳定性:Y>R
B. 简单离子的半径:X<Z<M
C. 最高价氧化物对应水化物的酸性:R<N
D. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质: ①蛋白质 ②脂类 ③糖类 ④无机盐 ⑤维生素 ⑥水.
其中属于人体需要的营养素有( )
A.①②③
B.①②③④
C.①②③④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________________。
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用_________。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取448 mL(标准状况)气体Y通入足量溴水中,发生下列反应:SO2+Br2+2H2O===2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。
[探究二] 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
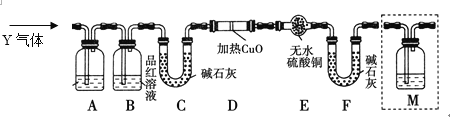
(3)装置B的作用是__________________________________________________。
(4)认为气体Y中还含有Q的理由是____________________ (用化学方程式表示)。
(5)为确认Q的存在,需要用到装置M,则M中装的试剂是______________,并将M添加于________(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是_____________________________。
(7)若某气体可能由CO2、SO2、H2中的一种或多种组成,经测定其中氧的质量分数为50%,则该气体的组成可能为___________(填序号)。
a.SO2 b.H2、SO2 c.H2、CO2 d.CO2、SO2 e.SO2、CO2、H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2FeO4是一种高效多功能水处理剂。制备Na2FeO4的方法如下:2FeSO4+6Na2O2 =2Na2FeO4 +2Na2O+2Na2SO4 +O2↑,对此反应下列说法中正确的是( )
A. 还原剂与氧化剂物质的量之比为1:3
B. 每生成44.8L氧气就有4 mol Fe2+ 被氧化
C. 还原产物是Na2FeO4和Na2O
D. 1mol FeSO4发生反应时,反应中共有4 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合是( )
分类组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2SO3 | H2SO4 | NaHCO3 | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | NO |
C | NaOH | CH3COOH | CaF2 | CO2 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO2 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com