
分析 (1)①根据溶液的配制过程选择仪器;
②NaOH溶液应该用碱式滴定管量取;
(2)①常温下0.1mol•L-1的HCl溶液的pH=1;
②根据醋酸未滴定前溶液的pH确定溶液里H+浓度;
③依据依据完全中和时溶液的pH情况及盐类水解分析;
解答 解:(1)①根据溶液的配制过程选择仪器,在定容时需要胶头滴管,故答案为:胶头滴管;
②NaOH溶液能腐蚀酸式滴定管中的活塞,所以要用碱式滴定管,故答案为:碱式;
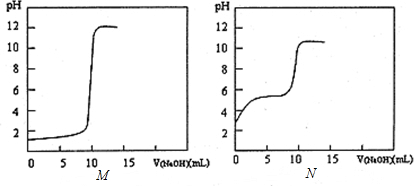
(2)①图M显示未滴定前溶液的pH=1,0.1mol•L-1的HCl溶液的pH=1,则M曲线为测定盐酸的曲线,故答案为:M;
②图N为滴定醋酸的曲线,未滴定前醋酸溶液的pH为3,即溶液里H+浓度为0.001mol/L,则20℃时该浓度醋酸中已电离的量与初始总量之比为0.001mol/L:0.1mol/L=1:100,故答案为:1:100;
③酸碱完全中和需要的NaOH溶液均为10.00mL,此时NaCl溶液的pH=7显中性,而CH3COONa溶液因CH3COO-的水解显碱性,此时溶液pH约为8,故滴定HCl溶液里需要继续滴加一定量的NaOH才可以使溶液的pH达到8,则两溶液中c(Na+)关系为M>N,故答案为:>.
点评 本题考查了中和滴定实验,以及弱酸的电离,盐类的水解,难度中等,要注意滴定管的选择.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
| A | B | C | D | |
| A | - | - | ↑ | |
| B | - | ↓ | ↓ | |
| C | - | ↓ | - | |
| D | ↑ | ↓ | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl中含有35Cl | |
| B. | 生成物Cl2的平均相对分子质量为73.3 | |
| C. | 1molK35ClO3参加反应,失去电子数为5NA | |
| D. | 氧化剂和还原剂的物质的量之比1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
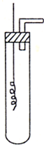 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na+、Ca2+、Cl-、NO3- | B. | Fe2+、H+、SO32-、ClO- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH+H2O═NaOH+H2↑ | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | F2+H2O═2HF+O2↑ | D. | Cl2+H2O?HCl+HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com