
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
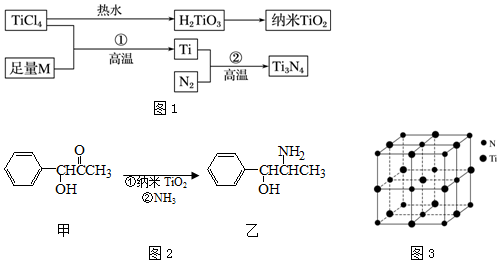
分析 (1)Ti是22号元素,其原子核外有22个电子,3d、4s电子为其外围电子,根据构造元素书写其外围电子排布式;
(2)M是短周期金属元素,根据其电离能知,该金属位于第IIA族,能还原四氯化钛,说明其金属性较强,为Mg;
该金属晶体的堆积模型为六方最密堆积,配位数=3×8÷2;
(3)化合物甲的分子中采取sp2方式杂化的碳原子价层电子对个数是3;
化合物乙中采取sp3方式杂化的原子有C、N、O元素,同一周期元素,元素的电负性随着原子序数增大而增大;
(4)根据均摊法,可知该晶胞中N原子个数为:$6×\frac{1}{2}+8×\frac{1}{8}=4$,该晶胞中Ti原子个数为:$1+12×\frac{1}{4}=4$,所以晶胞的质量m=4×$\frac{62}{N_A}g$,而晶胞的体积V=(2a×10-10)3cm3,所以晶体的密度=$\frac{m}{V}$;以晶胞顶点N原子为研究对象,与之距离相等且最近的N原子处于面心位置,每个顶点为8个晶胞共用.每个面为2个晶胞共用;
(5)离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高.
解答 解:(1)Ti为22号元素,原子核外电子排布为1s22s22p63S23p63d24s2,外围电子排布式为3d24s2,
故答案为:3d24s2;
(2)M是短周期金属元素,M的第三电离能剧增,处于ⅡA族,能与TiCl4反应置换出Ti,则M为Mg;Mg晶体属于六方最密堆积,配位数=3×8÷2=12,
故答案为:Mg;12;
(3)化合物甲的分子中采取sp2杂化的碳原子为苯环上的六个、羰基中的一个,共7个;采取sp3杂化的原子价层电子对数是4,乙中采取sp3杂化的原子有C、N、O,同一周期元素中,元素电负性随着原子序数依次增加电负性逐渐增大,所以它们的电负性关系为:O>N>C,
故答案为:7;O>N>C;
(4)根据均摊法,可知该晶胞中N原子个数为:$6×\frac{1}{2}+8×\frac{1}{8}=4$,该晶胞中Ti原子个数为:$1+12×\frac{1}{4}=4$,所以晶胞的质量m=4×$\frac{62}{N_A}g$,而晶胞的体积V=(2a×10-10)3cm3,所以晶体的密度ρ=4$\frac{62}{N_A}g$÷
(2a×10-10)3cm3=$\frac{4×62}{{{N_A}×(2a×{{10}^{-10}}{)^3}}}$g•cm-3;以晶胞顶点N原子为研究对象,与之距离相等且最近的N原子处于面心位置,每个顶点为8个晶胞共用;每个面为2个晶胞共用,故与之距离相等且最近的N原子为$\frac{3×8}{2}=12$,
故答案为:$\frac{4×62}{{{N_A}×(2a×{{10}^{-10}}{)^3}}}$;12;
(5)离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有TiN>CaO,由表中数据可知CaO>KCl,则TiN>CaO>KCl,
故答案为:TiN>CaO>KCl.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、离子晶体熔沸点比较、电负性大小比较等知识点,明确物质结构、元素周期律、原子结构等知识点是解本题关键,难点是(4)题“与之距离相等且最近的N原子个数”的判断,题目难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | Ka(HF) | C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$ | D. | $\frac{c({H}^{+})}{c(HF)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn、Fe | B. | Zn、Cu | C. | Fe、Cu | D. | Zn、Fe、Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.8mol/(L•min) | |
| B. | 2min末时的反应速率,用B表示为0.6mol/(L•min) | |
| C. | 用C表示的反应速率是0.4mol/(L•min) | |
| D. | 若用D表示反应速率是0.8mol/(L•min),则x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>a>c | B. | a>c>b | C. | c>a>b | D. | c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲醛(
苯甲醛( )、苯甲酸(
)、苯甲酸( )都是重要的化工原料,都可用甲苯(
)都是重要的化工原料,都可用甲苯( )为原料生产.下表列出了有关物质的部分物理性质,请回答:
)为原料生产.下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 ρ水=1g/cm3 | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
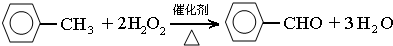 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com