
| A. | 温度升高,水中分子总数减少 | B. | 水中c(OH-)随温度升高而降低 | ||
| C. | 水的pH随温度升高而升高 | D. | 水的电离过程是放热过程 |
分析 水的离子积KW=c(H+)•c(OH-),水的离子积常数随温度升高而升高,说明水的电离为吸热过程,
A.升高温度,水的电离程度最大,水分子数目减少;
B.温度升高后水的电离程度最大,则氢离子、氢氧根离子浓度增大;
C.升高温度后氢离子浓度增大,水的pH减小;
D.水的电离过程为吸热过程.
解答 解:水的离子积KW=c(H+)•c(OH-),水的离子积常数随温度升高而升高,说明水的电离为吸热过程,
A.温度升高,水的电离程度最大,则水中分子总数减少,故A正确;
B.升高温度后水的电离程度最大,氢氧根离子浓度增大,即水中c(OH-)随温度升高而增大,故B错误;
C.温度升高水的电离程度最大,氢离子浓度增大,则水的pH减小,即水的pH随温度升高而降低,故C错误;
D.水的离子积常数随温度升高而升高,说明水的电离为吸热过程,故D错误;
故选A.
点评 本题考查水的电离及其影响,题目难度不大,根据题干信息明确水的电离为吸热过程为解答关键,注意熟练掌握弱电解质的电离平衡及其影响因素,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:填空题
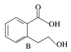 )的同分异构体的数目有4个;写出其中任意一个同分异构体的结构简式:
)的同分异构体的数目有4个;写出其中任意一个同分异构体的结构简式: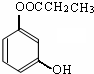 (或
(或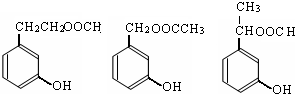 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯与钠形成离子键,氯与硅形成共价键 | |
| B. | 向淀粉KI溶液中滴加溴水,溶液变蓝 | |
| C. | 向Na2SO3溶液中滴加盐酸,有气泡生成 | |
| D. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铁溶液中滴加硫氰化钾溶液 | B. | 氯化铝中滴加石蕊指示剂 | ||
| C. | 偏铝酸钠溶液中滴加酚酞指示剂 | D. | 氯化亚铁溶液中滴加硫氰化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
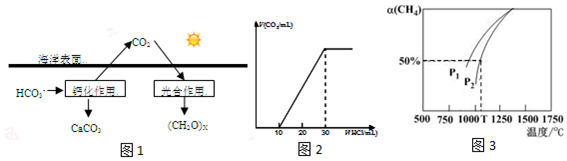
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com