
 ,分子中非金属元素电负性由大到小的顺序为O、N、C、H.
,分子中非金属元素电负性由大到小的顺序为O、N、C、H.
分析 (1)基态V元素的价层电子排布式为3d34s2,结合泡利原、洪特规则画出轨道表示式;同周期自左而右电负性增大,非金属性越强,电负性越大;
(2)采取sp2杂化的原子杂化轨道数目为3,而杂化轨道数目=σ键+孤对电子;V与N原子之间形成配位键;
(3)分子之间存在范德华力,分子内不同原子之间形成极性键、同种原子之间形成非极性键,不存在金属键与氢键;
(4)由Fe的晶胞结构,可知晶胞中Fe的堆积方式为体心立方密堆积;根据均摊法计算晶胞中Fe原子数目,表示出晶胞的质量,结合m=ρV计算晶胞棱长;
(5)体心碳原子与面心Fe原子距离最近;根据均摊法计算晶胞中Fe、C、Mn原子数目,进而确定化学式.
解答 解:(1)基态V元素的价层电子排布式为3d34s2,轨道表示式为 ;同周期自左而右电负性增大,非金属性越强,电负性越大,故电负性:O、N、C、H依次减小,
;同周期自左而右电负性增大,非金属性越强,电负性越大,故电负性:O、N、C、H依次减小,
故答案为: ;O、N、C、H;
;O、N、C、H;
(2)分子中C原子、N原子σ键均为3,均没有孤电子对,杂化轨道数目均为3,均采取sp2杂化,V与N原子之间形成配位键,1mol分子含有2mol配位键,即含有2NA个配位键,
故答案为:C、N;2NA;
(3)体中除配位键外,分子之间存在范德华力,分子内不同原子之间形成极性键、同种原子之间形成非极性键,不存在金属键与氢键,
故答案为:bcd;
(4)由Fe的晶胞结构,可知晶胞中Fe的堆积方式为体心立方密堆积,晶胞中Fe原子数目为1+8×$\frac{1}{8}$=2,则晶胞的质量为2×$\frac{56}{{N}_{A}}$g,设晶胞棱长为a cm,则:2×$\frac{56}{{N}_{A}}$g=ρg•cm-3×(a cm)3,解得a=$\root{3}{\frac{112}{ρ{N}_{A}}}$,
故答案为:体心立方密堆积;$\root{3}{\frac{112}{ρ{N}_{A}}}$;
(5)体心碳原子与面心Fe原子距离最近,则与C原子等距紧邻Fe的个数为4,
晶胞中Fe原子数目为7×$\frac{1}{8}$+4×$\frac{1}{2}$=$\frac{23}{8}$、C原子数目为1、Mn原子数目为2×$\frac{1}{2}$=1,Fe、Mn、C原子数目之比为23:8:8,故化学式为:Fe23Mn8C8,
故答案为:4;Fe23Mn8C8.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、杂化方式、化学键、配合物、晶胞结构及有关计算,掌握均摊法进行有关晶胞计算.


科目:高中化学 来源: 题型:解答题
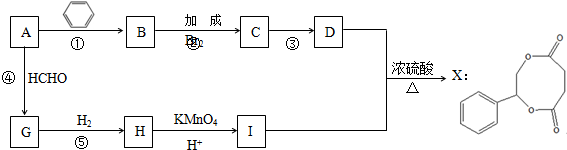
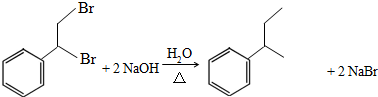 .
.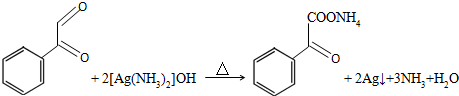 .
.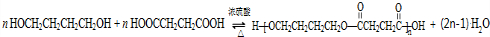 .
. 任意2种.
任意2种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂、钠、钾、铷、铯都具有碱性,故称为碱金属 | |
| B. | 石灰石、纯碱、小苏打、碳酸铵热稳定性最强的是纯碱 | |
| C. | 过氧化钠投入到饱和碳酸钠溶液既能产生白色沉淀,又能产生气体 | |
| D. | 金属Li是密度最小的碱金属,熔点大于Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.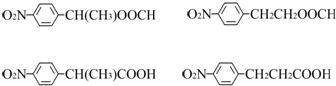 任意2种.
任意2种.
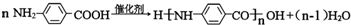 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2、BF3、NCl3分子中各原子均不满足最外层8电子结构 | |
| B. | 某化合物的焰色反应为黄色,则该化合物一定为钠盐 | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有6个 | |
| D. | 单质的晶体中一定不存在的微粒是阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
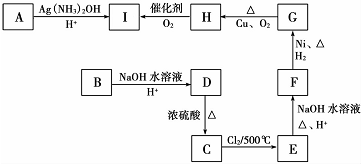
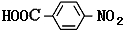
 、HOCH2CH2CH2CH2COOH.
、HOCH2CH2CH2CH2COOH. 、
、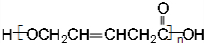 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,若阳极有64g铜放电溶解,则理论上电路中转移的电子数为2NA | |
| B. | 7.8g Na2O2与Na2S的混合物中含有的阴、阳离子的总数为0.3NA | |
| C. | 0.1 mol/LNa2CO3溶液中所含阴离子的总数大于0.1NA | |
| D. | 标准状况下22.4L三氯甲烷含有氯原子的数目是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X溶液 | 现象 |  | |
| A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
| B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
| C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
| D | 紫色石蕊溶液 | 溶液先变红后褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B元素在周期表中的位置为第二周期ⅣA族 | |
| B. | D的氧化物和E的单质的水溶液均有漂白性,且漂白的原理相同 | |
| C. | 由A、B、C、D组成的两种盐的溶液反应可产生DB2气体 | |
| D. | 上述元素的非金属气态氢化物还原性最强的是E |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com