
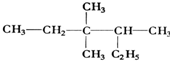
 3,3,4-三甲基己烷
3,3,4-三甲基己烷 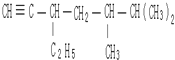 5,6-二甲基-3-乙基-1-庚炔
5,6-二甲基-3-乙基-1-庚炔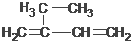 2-乙基-1,3-丁二烯
2-乙基-1,3-丁二烯 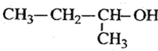 2-丁醇
2-丁醇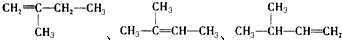 .
.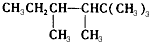 ,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.
,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构. 分析 (1)判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
(2)设烷烃的分子式为CxH(2x+2),根据相对分子质量为72,列出方程式进行计算x值,支链越多,沸点越低;
(3)烯烃为CnH2n,则12n+2n=70,解得n=5;根据该烯烃与氢气加成后得到的烷烃分子中含3个甲基解题;
(4)加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应.根据加成原理采取逆推法还原C=C双键或C≡C三键,烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置;
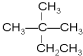
解答 解:(1) ,主碳链最长碳链含6个碳,离取代基近的一端编号,取代基位次和最小,名称为:3,3,4-三甲基己烷,
,主碳链最长碳链含6个碳,离取代基近的一端编号,取代基位次和最小,名称为:3,3,4-三甲基己烷,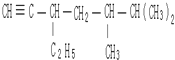 选取含三键在内的最长碳链含7个碳原子,离三键近的一端编号,名称为:5,6-二甲基-3-乙基-1-庚炔,
选取含三键在内的最长碳链含7个碳原子,离三键近的一端编号,名称为:5,6-二甲基-3-乙基-1-庚炔,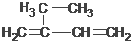 选取含碳碳双键在内的最长碳链为主碳链,含四个碳,离双键近的一端编号,取代基位次和最小,得到名称为:2-乙基-1,3-丁二烯,
选取含碳碳双键在内的最长碳链为主碳链,含四个碳,离双键近的一端编号,取代基位次和最小,得到名称为:2-乙基-1,3-丁二烯,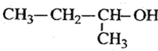 选取干羟基碳在内的最长碳链为主碳链,离羟基近的一端编号,得到名称:2-丁醇,
选取干羟基碳在内的最长碳链为主碳链,离羟基近的一端编号,得到名称:2-丁醇,
故答案为:3,3,4-三甲基己烷;5,6-二甲基-3-乙基-1-庚炔;2-乙基-1,3-丁二烯;2-丁醇;
(2)设烷烃的分子式为CxH(2x+2),
则14x+2=72,解得x=5,
所以该烷烃的分子式为C5H12,
分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的:CH3CH(CH3)CH2CH3,
主链有3个碳原子的:CH3C(CH3)2CH3;
支链越多,沸点越低,故CH3C(CH3)2CH3,
故答案为:CH3C(CH3)2CH3;
(3)烯烃为CnH2n,则12n+2n=70,解得n=5,分子式为C5H10;若该烯烃与氢气加成后得到的烷烃分子中含4个甲基,可能的结构简式: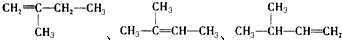 ,
,
故答案为:C5H10;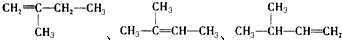 ;
;
(4)根据烯烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置.该烷烃的碳链结构为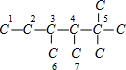 ,5号碳原子上没有H原子,与相连接T原子不能形成碳碳双键,能形成双键位置有:1和2之间;2和3之间;3和4之间,3和6之间,4和7之间,故该烃共有5种结构;
,5号碳原子上没有H原子,与相连接T原子不能形成碳碳双键,能形成双键位置有:1和2之间;2和3之间;3和4之间,3和6之间,4和7之间,故该烃共有5种结构;
故答案为:5;
点评 本题考查了有机物系统命名方法的应用,注意主链选择,起点编号原则,名称书写的规范方法,以加成反应为载体,考查同分异构体的书写,理解加成反应原理是解题的关键,采取逆推法还原C=C双键或三键,注意分析分子结构是否对称,防止重写、漏写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液:在一定量氨水溶液中,滴加AgNO3至沉淀恰好溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 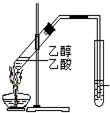 制备乙酸乙酯:用如图所示的实验装置 制备乙酸乙酯:用如图所示的实验装置 | |
| D. | 鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ④癸烷 ⑤CH3COOH
④癸烷 ⑤CH3COOH  ⑦
⑦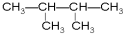 ⑧
⑧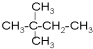 ⑨丙烷
⑨丙烷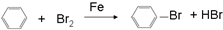 ;
; ;
;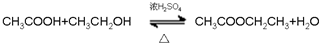 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化氢能使湿润的蓝色石蕊试纸变为红色,是因为HCl分子中含有H+ | |
| B. | 氯化氢极易溶于水,常温常压下1体积水可溶解500体积HCl | |
| C. | 氯化氢可以用向上排空气法收集 | |
| D. | 氯化氢和盐酸的化学式都是HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).
H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).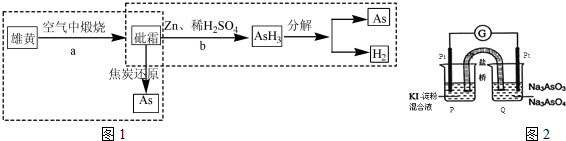
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ④ | C. | ① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑦ | ||||||
| 3 | ① | ③ | ④ | ⑥ | ⑧ | ⑨ | ⑩ | |
| 4 | ② |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化学反应的过程是吸热的 | |
| B. | 该化学反应的过程是放热的 | |
| C. | 分子运动速率加快,使反应物分子的碰撞机会增多 | |
| D. | 反应物分子的能量增加,活化分子百分数增加,有效碰撞次数增多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com