
分析 (1)根据氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;
(2)根据热化学方程式书写方法和注意问题标注物质聚集状态和对应焓变;
(3)甲醇燃料电池,甲醇在负极失电子发生氧化反应,氧气在正极放电,酸性条件下生成水;根据甲醇的燃烧热计算2mol甲醇完全燃烧放出的热量,结合原电池产生的电能计算;
(4)碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入0.1mol碱式碳酸铜[Cu2(OH)2CO3]相当于加入0.2molCuO、0.1molH2O,根据生成物知,阴极上铜离子和氢离子放电、阳极甲醇放电,根据铜和氢气的物质的量与转移电子之间的关系式计算转移电子的物质的量,并求消耗甲醇的质量.
解答 解:(1)由H2(g)的燃烧热△H为-285.8kJ•mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解10mol H2O(l)消耗的能量为285.8kJ×10=2858kJ,
故答案为:2858;
(2)H2(g)、CO(g)和CH3OH(1)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.6kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.6kJ•mol-1;
(3)酸性条件下甲醇燃料电池的总反应式为:CH3OH+$\frac{3}{2}$O2═CO2+2H2O①,酸性条件下该燃料电池的正极反应式为$\frac{3}{2}$O2+6H++6e-═3H2O②,①-②得电池负极反应式为:CH3OH+H2O-6e-═CO2+6H+;该燃料电池的理论效率为$\frac{701.8kJ}{726.5kJ}$×100%=96.6%,
故答案为:CH3OH+H2O-6e-═CO2+6H+;$\frac{3}{2}$O2+6H++6e-═3H2O;96.6%;
(4)碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入0.1mol碱式碳酸铜[Cu2(OH)2CO3]相当于加入0.2molCuO、0.1molH2O,根据生成物知,阴极上铜离子和氢离子放电、阳极上甲醇放电,根据Cu原子、H原子守恒得阴极上析出n(Cu)=0.2mol、n(H2)=0.1mol,则转移电子的物质的量=0.2mol×2+0.1mol×2=0.6mol,
阳极:CH3OH+H2O-6e-═CO2+6H+
32g 6mol
3.2g 0.6mol
则:m(CH3OH)=3.2g,
故答案为:3.2.
点评 本题考查了热化学方程式的书写和盖斯定律的应用、原电池电极方程式的书写,电极材料计算等知识,本题题目难度中等.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
| A. | 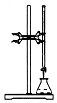 用标准氢氧化钠溶液滴定未知浓度的盐酸 | |
| B. | 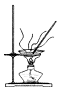 加热FeCl3溶液获取FeCl3固体 | |
| C. | 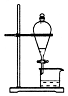 用酒精萃取碘水中的碘 | |
| D. | 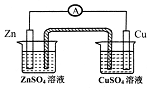 通过原电池原理证明金属性Zn>Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法不正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法不正确的是( )| A. | 每“呼出”22.4LCO2,转移电子数为$\frac{4}{3}$mol | |
| B. | “吸入”CO2时的正极反应:4Na++3CO2+4e-=2Na2CO3+C | |
| C. | “呼出”CO2时钠箔电极反应式是Na++e-=Na | |
| D. | 放电时电池总反应是4Na+3CO2=2Na2CO3+C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 体积V/ml | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大气中PM2.5比表面积大,吸附力强,能吸附许多有毒、有害物质 | |
| B. | Na2S具有还原性,作废水中Cu2+、Hg2+沉淀剂 | |
| C. | 石墨烯一种由单层碳原子构成的新纳米材料,具有导电性 | |
| D. | 刚玉、红宝石主要或分是氧化铝,陶瓷、分子筛主要成分是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③④⑤ | C. | ①③④ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com