
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c(SO42-) |
分析 莫尔盐的化学式为(NH4)2Fe(SO4)2,(NH4)2Fe(SO4)2完全电离:(NH4)2Fe(SO4)2=2NH4++Fe2++2SO42-,因NH4+、Fe2+水解,导致c(NH4+)、c(Fe2+)浓度减小,则c(SO42-)>c(NH4+)>c(Fe2+),水解后溶液呈酸性,则c(H+)>c(OH-),溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);溶液中满足电荷守恒:2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+)、物料守恒:c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c(SO42-),据此进行判断.
解答 解:莫尔盐的化学式为(NH4)2Fe(SO4)2,(NH4)2Fe(SO4)2完全电离:(NH4)2Fe(SO4)2=2NH4++Fe2++2SO42-,
A.NH4+、Fe2+部分水解,且水解程度较小,导致c(NH4+)、c(Fe2+)浓度减小,则c(SO42-)>c(NH4+)>c(Fe2+),水解后溶液呈酸性,则c(H+)>c(OH-),溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故A正确;
B.由于铵根离子部分水解,导致c(NH4+)减小,则c(SO42-)>c(NH4+),故B错误;
C.根据溶液中的电荷守恒可得:2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+),故C正确;
D.根据溶液中的物料守恒可得:c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c(SO42-),故D正确;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,注意掌握盐的水解原理,能够根据电荷守恒、物料守恒及盐的水解原理判断溶液中离子浓度大小.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 凡金属跟非金属元素化合时都能形成离子键 | |
| B. | 离子化合物熔融状态下一定导电 | |
| C. | 离子化合物中的阳离子只能是金属离子,酸根离子中不能含有金属元素 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0015 g•cm-3 | B. | 0.0012 g•cm-3 | C. | 0.0024 g•cm-3 | D. | 0.002 g•cm-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色 | |
| B. | 已知铬酸根(黄色)和重铬酸根(橙色)离子间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O,若加水稀释,则溶液中所有离子浓度均减少 | |
| C. | 若反应2A(g)+B(s)?C(g)+3D(g)只有高温下才能自发进行,则该反应的△H>0 | |
| D. | 增大反应物的浓度,可使单位体积内活化分子数目增多,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
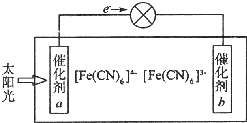 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: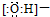 | B. | 硫原子的原子结构示意图: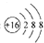 | ||
| C. | 乙烯分子的实验式:C2H4 | D. | 3,3一二甲基一1一戊烯的键线式: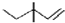 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 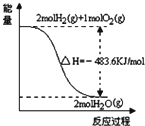 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为-241.8kJ•mol-1 | |
| B. | 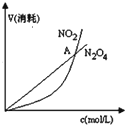 表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 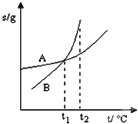 表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 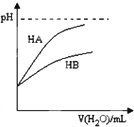 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化.则NaA溶液的pH小于等物质的量浓度的NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| B. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | NaHCO3和过量的澄清石灰水反应:2HCO3-+2OH-+Ca2+═CaCO3↓+CO32-+2H2O | |
| D. | NH4HSO3溶液与足量NaOH溶液混合加热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com