

| A. | ①中,d极发生氧化反应、c极发生还原反应 | |
| B. | ②中从a口通入气体,可用于收集H2、NH3、CH4等气体 | |
| C. | ③中X若为CCl4,上层为稀硫酸,可用于吸收氨气,并防止倒吸 | |
| D. | ④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
分析 A.图中电流方向判断电源a为正极,b为负极,c为阳极,d为阴极,原电池中负极发生氧化反应,电解池中阳极发生氧化反应;
B.装置分析可知,a进b出是用于收集比空气轻的气体且不和空气中气体发生反应;
C.氨气和稀硫酸发生反应,氨气在四氯化碳中不溶解不反应,可以吸收氨气防止倒吸;
D.碱石灰可以吸收氯化氢,氯化氢比空气重.
解答 解:A.图中电流方向判断电源a为正极,b为负极,c为阳极,d为阴极,原电池中负极发生氧化反应,电解池中阳极发生氧化反应,d极发生还原反应、c极发生氧化反应,故A错误;
B.装置分析可知,a进b出是用于收集比空气轻的气体且不和空气中气体发生反应,可用于收集H2、NH3、CH4等比空气轻且不和空气中氧气反应的气体,故B错误;
C.氨气和稀硫酸发生反应,氨气在四氯化碳中不溶解不反应,可以吸收氨气防止倒吸,装置可用于吸收氨气,并防止倒吸,故C正确;
D.碱石灰可以吸收氯化氢,收集装置也错误,故D错误;
故选C.
点评 本题考查了原电池、电解池原理、电极反应、气体收集、气体吸收等实验基本操作,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题

| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚二氧化碳塑料是通过缩聚反应生成的 | |
| B. | 聚二氧化碳塑料的结构式可表示为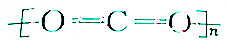 | |
| C. | 聚二氧化碳塑料属于纯净物,相对分子质量为44n | |
| D. | 聚二氧化碳塑料是属于环境友好材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生的气体溶于水中,能使酚酞变红 | |
| B. | 催化剂保持红热 | |
| C. | 可能生成红棕色的气体 | |
| D. | 可能产生白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
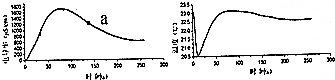
| A. | 冰醋酸稀释过程中,溶液的导电能力先增大后减小 | |
| B. | 左图的曲线也可以表示溶液的pH变化趋势 | |
| C. | 稀释一开始,溶液的温度就下降,可推知电离过程可能是吸热过程 | |
| D. | 可通过微热的方法,使图中a点溶液中的c(CH3COO-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com