
【题目】下列物质因水解而呈酸性的是
A.NaClOB.CH3COOHC.KBrD.NH4Cl
科目:高中化学 来源: 题型:
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
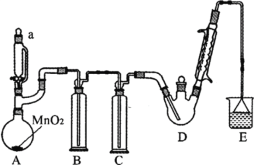
①制备反应原理:C2H5OH + 4Cl2 → CCl3CHO+5HCl
可能发生的副反应:
C2H5OH + HCl → C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)仪器a中盛放的试剂是_____ ;装置B的作用是__________ 。
(2)若撤去装置C,可能导致装置D中副产物________ (填化学式)的量增加;装置D可采用_________ 加热的方法以控制反应温度在70℃左右。
(3)装置E中可能发生的无机反应的离子方程式有____________________ 。
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?_______________
(5)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol·L-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 mol·L-1 Na2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为_________。
滴定的反应原理:CCl3CHO +OH- → CHCl3 + HCOO-、 HCOO-+ I2 =H+ + 2I- + CO2↑ I2 + 2S2O32- = 2I-+ S4O62-
(6)请设计实验证明三氯乙酸的酸性比乙酸强。 __________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除 CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 CO2 创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol
②C(s)+2H2(g)![]() CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
③2CO(g)![]() C(s)+CO2(g) △H=-17kJ/mol
C(s)+CO2(g) △H=-17kJ/mol
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____。
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:
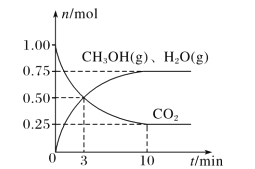
①从反应开始到平衡,氢气的平均反应速率v(H2)= ____。
②下列措施一定不能使CO2的平衡转化率增大的是____ (填字母)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
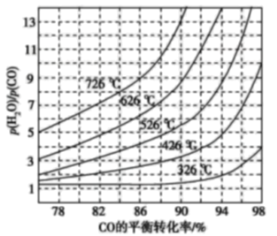
①上述反应的正反应方向是 ____(填“吸热”或“放热”)反应;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是 _______,如果提高p(H2O)/p(CO),则Kp_______ (填“变大”“变小”或“不变”);使用铁镁催化剂的实际工业流程中,一般采用400℃左右,p(H2O)/p(CO) =3~5,采取此条件的原因可能是 _________ 。
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是 ____(填字母)。
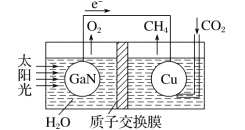
A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,该溶液中氯离子的物质的量浓度为( )
A.0.5 mol·L-1B.2 mol·L-1
C.2.5 mol·L-1D.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。
基态Co原子核外电子排布式为___________________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为___________________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。在CO分子中,σ键与π键数目之比为_________。
(3)铁与K2O、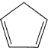 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(4)与铁同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种,往其溶液中加BaCl2溶液时,有白色沉淀;加入AgNO3溶液时,没有沉淀生成;加入氢氧化钠溶液时,无气体生成。则此种配合物的化学式为 _________________________。
(5)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
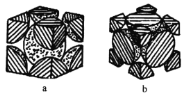
在图a所示堆积方式里铁原子的堆积方式为___________________________。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为(空间利用率)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.![]() 、
、![]() 、
、![]() 互为同系物
互为同系物
B.有机化合物 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.含有5个碳原子的饱和链烃,其一氯取代物有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.![]() 、
、![]() 、
、![]() 互为同系物
互为同系物
B.有机化合物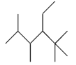 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.含有5个碳原子的饱和链烃,其一氯取代物有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废渣的主要成分为 SiO2、FeO、MgO,对其进行处理以回收废渣中的金属元素。25℃时,金属离子的物质的量浓度的负对数(-lg c)与溶液pH的关系如图所示(一般离子浓度 c≤10-5mol/L时,即认为该离子在溶液中不存在)。下列有关说法不正确的是
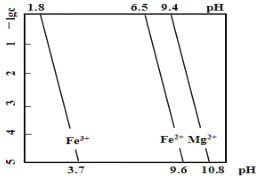
A.分离废渣中的SiO2,可以用过量的盐酸充分反应后过滤
B.可以用氯水将Fe2+氧化成Fe3+以便于铁元素与镁元素的分离
C.沉淀金属元素的顺序是先沉淀镁元素再沉淀铁元素
D.用 NaOH 调节pH沉淀铁元素时,pH应控制略大于3.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用酸性蚀刻废液(含![]() 等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
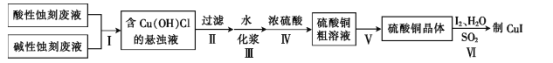
(1)步骤Ⅰ中发生了多个反应,其中![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为____。
与盐酸反应生成Cu(OH)Cl的离子方程式为____。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是____。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。
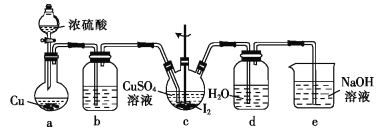
①装置a中盛装浓硫酸的仪器的名称是___,圆底烧瓶中发生反应的化学方程式为___。
②装置c中反应完成的现象是_____。
③用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com