
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| c(NO2) |
| c2( NO)c(O2) |
| c(NO2) |
| c2( NO)c(O2) |
| 0.005mol/L-0.002mol/L |
| 2s |


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
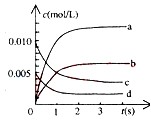
 �ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| c(NO2) |
| c2( NO)c(O2) |
| c(NO2) |
| c2( NO)c(O2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
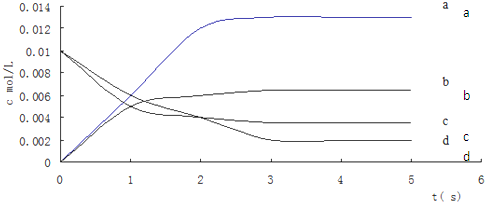
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2L�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��
��2L�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g�� 2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
| C2(NO2) |
| C2(NO)C(O2) |
| C2(NO2) |
| C2(NO)C(O2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
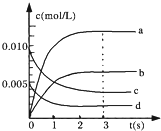 �� I����2L�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��Ľ������±���
�� I����2L�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��Ľ������±���| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��09-10ѧ���ˮһ�и߶���ѧ�����п��Ի�ѧ�� ���ͣ������
��6�֣���2L�ܱ������У�800��ʱ��Ӧ2NO(g)��O2(g) 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
|
ʱ�䣨s�� |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)��mol�� |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)ͼ�б�ʾNO2�ı仯��������____________��
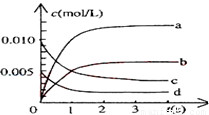
(2)��˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����___________��
a.v(NO2)=2v(O2) b.������ѹǿ���ֲ���
c.v(NO)�棽2v(O2)�� d.�����ڵ��ܶȱ��ֲ���
(3)Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����
__________��
a.��ʱ�����NO2���� b.�ʵ������¶�
c.����O2��Ũ�� d.ѡ���Ч�Ĵ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com