
【题目】乙二胺(H2NCH2CH2NH2)是二元弱碱,在水中的电离原理类似于氨。常温下,向乙二胺溶液中滴加稀盐酸,溶液的pH随离子浓度变化关系如图所示。下列叙述不正确的是( )
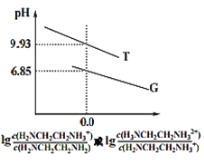
A.Kb2[H2NCH2CH2NH2]的数量级为10-8
B.曲线G代表pH与lg![]() 的变化关系
的变化关系
C.H3NCH2CH2NH2Cl溶液中c(H+)>c(OH-)
D.0.01mol·L-1H2NCH2CH2NH2电离度约为10%
【答案】C
【解析】
多元弱碱的第一级电离大于第二级电离,故曲线T代表pH与lg![]() 的变化关系,曲线G代表pH与lg
的变化关系,曲线G代表pH与lg![]() 的变化关系,由曲线所示关系和电离平衡常数相关知识分析可得结论。
的变化关系,由曲线所示关系和电离平衡常数相关知识分析可得结论。
A.Kb2[H2NCH2CH2NH2]=![]() ,当lg
,当lg![]() =0时,即
=0时,即![]() =
=![]() ,Kb2[H2NCH2CH2NH2]=
,Kb2[H2NCH2CH2NH2]=![]() =10-7.15,故A正确;
=10-7.15,故A正确;
B.根据分析,因多元弱碱的第一级电离大于第二级电离,曲线G代表pH与lg![]() 的变化关系,故B正确;
的变化关系,故B正确;
C.在H3NCH2CH2NH2Cl溶液中,既有H2NCH2CH2NH3的电离,又有H2NCH2CH2NH3+的水解,由图中T曲线可得H2NCH2CH2NH3+的水解平衡常数Kh=c(H+)=10-9.93,而Kb2[H2NCH2CH2NH2]= 10-7.15,由此可知在H3NCH2CH2CH2NH3+的电离大于水解,溶液显碱性,故C错误;
D.设0.01molL-1H2NCH2CH2NH2电离度为a,则有Kb1[H2NCH2CH2NH2]=![]() =10-4.07,解得a=0.1,故D正确;
=10-4.07,解得a=0.1,故D正确;
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
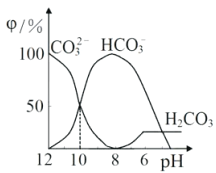
A. pH=7时, c(Na+)=(Cl- )+c(HCO3-)+2c(CO32-)
B. pH=8时,c(Na+)=c(C1-)
C. pH=12时, c(Na+ )>c(OH- )>c(CO32-)>c(HCO3-)>c(H+)
D. 25℃时,CO32-+H2O![]() HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )

A.d为石墨,电流从d流入导线进入铁片
B.d为铜片,铜片上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为镁片,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
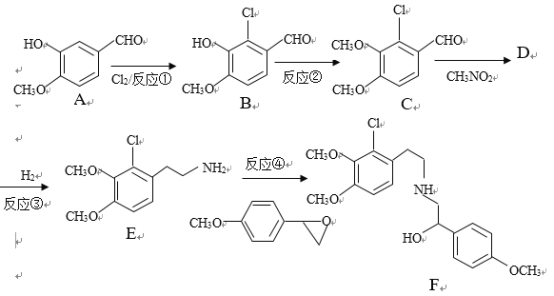
【题目】某药物合成中间体F制备路线如下:
已知:RCHO+R’CH2NO2![]()
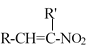 +H2O
+H2O
(1)有机物A结构中含氧官能团的名称是__________________.
(2)反应②中除B外,还需要的反应物和反应条件是___________________
(3)有机物D的结构简式为_____________________,反应③中1摩尔D需要___摩尔H2才能转化为E
(4)反应④的反应物![]() 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
a.结构中含4种化学环境不同的氢原子
b.能发生银镜反应
c.能和氢氧化钠溶液反应
(5)已知:苯环上的羧基为间位定位基,如![]()
![]()
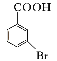 。写出以
。写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)_____________。
的合成路线流程图(无机试剂任选)_____________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两份混合气体,A是烯烃R与足量O2的混合气体;B是烯烃R、炔烃Q与足量O2的混合气体。取A、B各2.24L分别引燃,A充分燃烧后气体总体积仍为2.24L,B充分燃烧后气体总体积为2.34L(燃烧后的产物均为气态,其体积已换算成标准状况)。通过计算,写出:
(1)烯烃R的分子式____________________。
(2)炔烃Q的分子式____________________。
(3)求2.24L B中烯烃R所允许的最大体积是_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
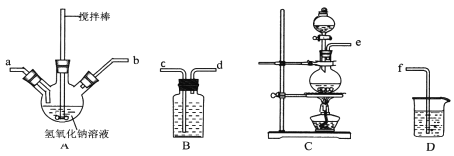
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
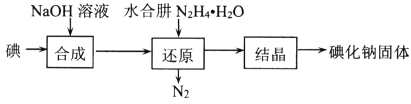
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀―现象产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
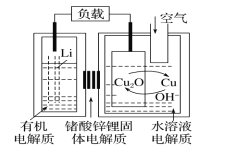
A.放电时,Li+透过固体电解质向右移动
B.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,0.1000 mol/L Na2CO3溶液25 mL用0.1000 mol/L盐酸滴定,其滴定曲线如图。
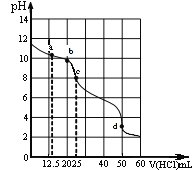
对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是
A.a点:c(CO32-)>c(HCO3-)>c(OH-)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com