
 面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.分析 (1)二氧化硫与过量的氢氧化钠反应生成亚硫酸钠和水;
(2)已知合成液态甲醇的热化学方程式为:CO(g)+2H2(g)=CH3OH(l)△H=+131.9kJ/mol,又已知4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kJ/mol;利用盖斯定律可求出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式;
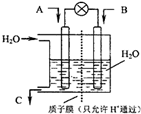
(3)①H2失去电子,故H2的一极为负极;
②SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+;
(4)①K=$\frac{c(N2O4)}{C2(NO2)}$=13.3,再根据c(NO2)=0.030mol/L,可求出c(N2O4);
②改变上述体系的某个条件,达到新的平衡后,根据c(NO2)和c(N2O4)求出K值,K减小,说明升高了温度,平衡逆向移动.
解答 解:(1)二氧化硫与氢氧化钠反应的离子方程式:2OH-+SO2═SO32-+H2O,故答案为:2OH-+SO2═SO32-+H2O;
(2)已知合成液态甲醇的热化学方程式为:CO(g)+2H2(g)=CH3OH(l)△H=+131.9kJ/mol,又已知4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kJ/mol;利用盖斯定律可求出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1452kJ/mol,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1452kJ/mol;
(3)①H2失去电子,故H2的一极为负极,故答案为:负;
②SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+,故答案为:SO2+2H2O-2e-=SO42-+4H+;
(4)①K=$\frac{c(N2O4)}{C2(NO2)}$=13.3,再根据c(NO2)=0.030mol/L,可求出c(N2O4)=0.012mol/L,故答案为:0.012mol/L;
②改变上述体系的某个条件,达到新的平衡后,根据c(NO2)和c(N2O4)求出K=4.375,K减小,说明升高了温度,平衡逆向移动,故答案为:升高温度.
点评 本题属于拼合型题目,涉及热化学方程式书写、反应热计算、化学平衡有关计算及影响因素、电解池等,侧重考查学生对知识的迁移应用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 埋在潮湿土壤里的铁管比在干燥土壤中的更易被腐蚀 | |
| B. | 在空气中,金属镁、铝的表面可形成一层氧化膜 | |
| C. | 为保护海轮的船壳,常在海轮上镶嵌锌块 | |
| D. | 镀锡的铁制品,镀层部分破坏后,露出的铁表面更容易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2(CuO) | B. | NaOH(NaOH) | C. | CuSO4(CuO) | D. | NaCl(盐酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | Cl2O | C. | Cl2O3 | D. | ClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚遇石蕊显红色 | B. | 包装用材料聚氯乙烯属于烃 | ||
| C. | 食用花生油能发生水解反应 | D. | PX项目中的对二甲苯属于饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 标准状况下,4.0 g CH4中含有共价键的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com