
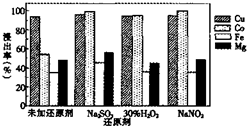
| A���Ƿ�ʹ�û�ԭ����ͭ�Ľ�����Ӱ��ܴ� |
| B����Na2SO3NaNO2����ԭ�����ܵĽ����� ����98%������ҵ����ѡ��Na2SO3 |
| C�����뻹ԭ������ҪĿ����Ϊ�˻�ԭFe3+ |
| D����Na2SO3����ԭ����ʹþԪ���Ե��� ��ʽ�������нϴ������ |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��78g | B��15.6g |
| C��7.8g | D��3.9g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ԭ������ X��Y |
| B��ԭ�Ӱ뾶 X��Y |
| C�����Ӱ뾶 X��Y |
| D��ԭ������������ X��Y |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Mn2+��MnO4- |
| B��Cl2��Cl- |
| C��H2��H2O |
| D��Zn��Zn2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��3��5 | B��3��2 |
| C��2��3 | D��5��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��HCl��MgCl2 |
| B��Na��Na+ |
| C��CO��CO2 |
| D��Fe3+��Fe |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
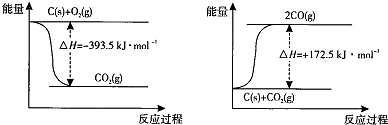
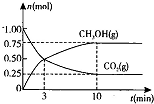
| ������� | H2CO3 | NH3��H2O |
| ����ƽ�ⳣ���� 25�棩 | Ka1=4.30��10-7 Ka2=5.61��10-11 | Kb=1.77��10-5 |
| Kw |
| Kb |
| Kw |
| Ka2 |
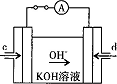
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | ||||||||
| �� | �� | |||||||
| �� | �� | �� | ||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com