
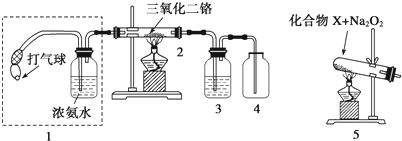
分析 空气通过浓氨水其中氨气和氧气进入硬质玻璃管中在三氧化铬催化剂作用下加热反应,发生氨气的催化氧化生成一氧化氮气体和水蒸气,通过装置3中浓硫酸干燥进入装置4收集,
(1)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键;
(2)氨气具有还原性,在催化剂作用下可与氧气反应被氧化为NO;
(3)根据反应现象判断,停止加热后仍能保持红热,即可说明该反应放热;
(4)Cr原子序数为24,根据能量最低原理分析核外电子排布;轨道上电子处于全空、半满、全满时原子最稳定;
(5)红棕色气体为NO2,易与水反应,应干燥,如不干燥,NO2与水反应生成硝酸,进而与氨气生成硝酸铵;
(6)装置1能提供氨气和氧气,装置5也能提供氨气和氧气,装置5中应加入氯化铵和过氧化钠,可生成氨气和氧气.
解答 解:(1)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、O-H…O、N-H…N,氨水中NH3分子与水分子间形成的可能存在的氢键N-H…N、N-H…O、O-H…N、O-H…O,
故答案为:N-H…N、N-H…O、O-H…N、O-H…O;
(2)氨气具有还原性,在催化剂作用下可与氧气反应被氧化为NO,反应方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
(3)停止加热后仍能保持红热,即可说明该反应放热,故答案为:放热;
(4)铬是24号元素,基态原子核外有24个电子,根据构造原理,能级大小顺序为1s、2s、2p、3s、3p、4s、3d,先排4s能级后排3d能级,但轨道上电子处于全空、半满、全满时原子最稳定,所以该原子基态时,4s排1个电子3d排5个电子,核外电子排布式为1s22s22p63s23p63d54s1,3d、4s轨道上的电子均为半充满状态,这样排布使整个体系能量最低,
故答案为:1s22s22p63s23p63d54s1;3d、4s轨道上的电子均为半充满状态;
(5)NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3,可观察到白烟生成,NO2易与水反应,应干燥,如不干燥,NO2与水反应生成硝酸而观察不到颜色,所以装置3中为浓硫酸用来干燥气体,
故答案为:浓H2SO4;
(6)装置1能提供氨气和氧气,装置5也能提供氨气和氧气,装置5中应加入氯化铵和过氧化钠,可生成氨气和氧气,反应为:NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$HCl+NH3,2HCl+Na2O2═2NaCl+O2+H2O,其中X为氯化铵,存在的化学键类型为:离子键、共价键,
故答案为:离子键、共价键.
点评 本题考查氨气的制取原理、反应装置及化学性质,题目较为综合,涉及氨气的制取、性质以及二氧化氮和硝酸铵等知识,注意把握元素化合物知识的理解和应用.


科目:高中化学 来源: 题型:选择题
| A. | O2和O3互为同素异形体 | |
| B. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{3}$H互为同位素 | |
| C. | CH2═CH2和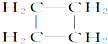 互为同系物 互为同系物 | |
| D. | 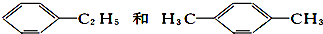 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=4,n=2 | B. | m=4,n=5 | C. | m=3,n=3 | D. | m=5,n=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
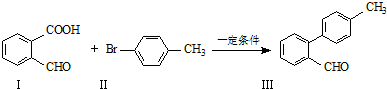
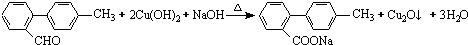 .
.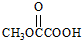 与
与  也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为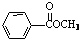 .
.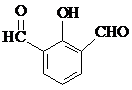 、
、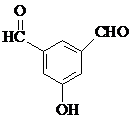 、
、 (要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1 的KCl溶液 | B. | 0.1L 0.2mol•L-1的盐酸溶液 | ||
| C. | 0.1L 0.1 mol•L-1的MgCl2溶液 | D. | 0.1L 0.1mol•L-1的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
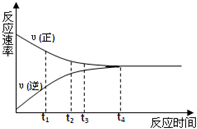 一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )| A. | t3时刻,υ(正)>υ(逆) | B. | t4时刻,υ(正)=υ(逆) | ||
| C. | t4时刻,反应达到最大限度 | D. | t4时刻,反应停止 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com