
| A. | FeCl3溶液中:K+、Na+、SO42-、OH- | |
| B. | 使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3- | |
| C. | 漂白粉溶液中:H+、Na+、I-、Cl- | |
| D. | 与铝反应产生氢气的溶液中:Na+、K+、CO32-、OH- |
分析 A.离子之间结合生成沉淀;
B.使酚酞试液变红的溶液,显碱性;
C.离子之间发生氧化还原反应;
D.与铝反应产生氢气的溶液,为非氧化性酸或强碱溶液.
解答 解:A.Fe3+、OH-结合生成沉淀,不能共存,故A不选;
B.使酚酞试液变红的溶液,显碱性,不能大量存在NH4+、HCO3-,故B不选;
C.H+、ClO-、Cl-发生氧化还原反应,H+、ClO-、I-发生氧化还原反应,不能共存,故C不选;
D.与铝反应产生氢气的溶液,为非氧化性酸或强碱溶液,碱溶液中该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:多选题
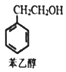 →
→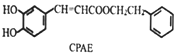
| A. | 苯乙醇分子中含有1个手性碳原子 | |
| B. | 与苯乙醇互为同分异构体的芳香醇有4种 | |
| C. | 苯乙醉及CPAE都能发生取代、加成和消去反应 | |
| D. | 1 mol CPAE最多可与含3 molNaOH的溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 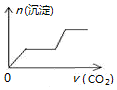 | B. | 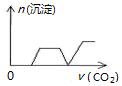 | C. | 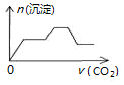 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
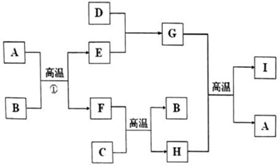 有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中.
有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
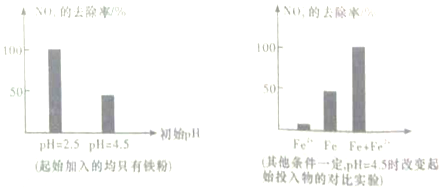
| A. | pH=4.5时,NO3-的去除率低,其原因可能是FeO(OH) 不导电,阻碍电子转移 | |
| B. | 通过对比试验发现,在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率,可能原因是Fe2+将NO3-直接还原了 | |
| C. | 加入Fe2+可能发生的反应是Fe2++2FeO(OH)═Fe3O4+2H+ | |
| D. | 由图猜测,溶液中H+浓度越大,对NO3-的去除率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中CO32-水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | Al溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| D. | 向Ba(OH)2溶液中加少量稀H2SO4:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 | Ka1=4.4×10-7 | H2C2O4 | Ka1=5.4×10-2 |
| Ka2=4.7×10-11 | Ka2=5.4×10-5 |
| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com