
用KMnO4与足量浓度为12mol/L的浓盐酸反应,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl 2+ 5Cl 2↑ +8H2O
回答下列问题:
(1)2molKMnO4的质量为多少?
(2)2molKMnO4能氧化的HCl物质的量为多少?
(3)产生的Cl 2在标准状况下的体积为多少?
(1)316g (2)10mol (3)112L
【解析】
试题分析:(1)高锰酸钾的摩尔质量是158g/mol,所以2molKMnO4的质量=158g/mol×2mol=316g。
(2)高锰酸钾中Mn元素的化合价从+7价降低到+2价,得到5个电子,则2mol高锰酸钾得到2mol×5=10mol电子。氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,因此2molKMnO4能氧化的HCl物质的量=10mol÷1=10mol。
(3)根据以上分析可知,得到1mol氯气转移2mol电子,所以根据电子的得失守恒可知生成氯气的物质的量=10mol÷2=5mol,在标准状况下的体积=5mol×22.4L/mol=112L。
考点:考查氧化还原反应与物质的量的有关计算


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
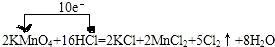
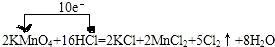
查看答案和解析>>
科目:高中化学 来源:常州中学高一化学(必修1)期中考试试题2006-2007学年上学期(新人教版) 题型:038
| |||||||||||
查看答案和解析>>
科目:高中化学 来源:高一新课标上学期期中测试题化学(期中) 题型:038
| |||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com