
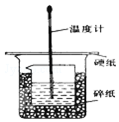
 ijŹµŃ銔×éÉč¼ĘÓĆ50mL 1.0mol/LŃĪĖįøś50mL 1.1mol/L ĒāŃõ»ÆÄĘČÜŅŗŌŚČēĶ¼×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®ŌŚ“óÉÕ±µ×²æµęĖéÅŻÄĖÜĮĻ£Ø»ņÖ½Ģõ£©£¬Ź¹·ÅČėµÄŠ”ÉÕ±±æŚÓė“óÉÕ±±æŚĻąĘ½£®Č»ŗóŌŁŌŚ“󔢊”ÉÕ±Ö®¼äĢīĀśĖéÅŻÄĖÜĮĻ£Ø»ņÖ½Ģõ£©£¬“óÉÕ±ÉĻÓĆÅŻÄĖÜĮĻ°å£Ø»ņÓ²Ö½°å£©×÷øĒ°å£¬ŌŚ°åÖŠ¼äæŖĮ½øöŠ”æ×£¬ÕżŗĆŹ¹ĪĀ¶Č¼ĘŗĶ»·ŠĪ²£Į§½Į°č°ōĶعż£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮææɼĘĖćÖŠŗĶČČ£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
ijŹµŃ銔×éÉč¼ĘÓĆ50mL 1.0mol/LŃĪĖįøś50mL 1.1mol/L ĒāŃõ»ÆÄĘČÜŅŗŌŚČēĶ¼×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®ŌŚ“óÉÕ±µ×²æµęĖéÅŻÄĖÜĮĻ£Ø»ņÖ½Ģõ£©£¬Ź¹·ÅČėµÄŠ”ÉÕ±±æŚÓė“óÉÕ±±æŚĻąĘ½£®Č»ŗóŌŁŌŚ“󔢊”ÉÕ±Ö®¼äĢīĀśĖéÅŻÄĖÜĮĻ£Ø»ņÖ½Ģõ£©£¬“óÉÕ±ÉĻÓĆÅŻÄĖÜĮĻ°å£Ø»ņÓ²Ö½°å£©×÷øĒ°å£¬ŌŚ°åÖŠ¼äæŖĮ½øöŠ”æ×£¬ÕżŗĆŹ¹ĪĀ¶Č¼ĘŗĶ»·ŠĪ²£Į§½Į°č°ōĶعż£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮææɼĘĖćÖŠŗĶČČ£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ| ŹµŃéŠņŗÅ | ĘšŹ¼ĪĀÖŻ t1/”ę | ÖÕÖ¹ĪĀ¶Č£Øt2£©/”ę[ | ĪĀ²ī £Øt2-t1£©/”ę | ||
| ŃĪĖį | NaOHČÜŅŗ | Ę½¾łÖµ | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
·ÖĪö £Ø1£©øł¾Ż×°ÖĆĶ¼·ÖĪöȱɣµÄŹµŃéŅĒĘ÷£»ÖŠŗĶČČ²ā¶ØŹµŃé³É°ÜµÄ¹Ų¼üŹĒ±£ĪĀ¹¤×÷£»
£Ø2£©ĪĀ²ī£Øt2-t1£©Ó¦Č”Čż“ĪŹµŃéµÄĘ½¾łÖµ6.7”꥓¼ĘĖćÖŠŗĶČČ£¬øł¾ŻÖŠŗĶČȵÄøÅÄīŠ“³öøĆÖŠŗĶ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½
£Ø3£©øł¾Ż“×ĖįĪŖČõµē½āÖŹ£¬µēĄė¹ż³ĢÖŠŠčŅŖĪüŹÕČČĮæ½ųŠŠÅŠ¶Ļ£»
£Ø4£©Ć»ÓŠÓĆĖ®Ļ“µÓĪĀ¶Č¼ĘÉĻµÄŃĪĖįČÜŅŗ£¬µ¼ÖĀŃĪĖįµÄĪļÖŹµÄĮæĘ«Š”£¬·Å³öµÄČČĮæĘ«Š”£®
½ā“š ½ā£ŗ£Ø1£©ÖŠŗĶČČ²ā¶ØµÄŹµŃéÖŠŠčŅŖĮæĶ²”¢ĪĀ¶Č¼Ę”¢»·ŠĪ²£Į§½Į°č°ō£¬»¹Č±ÉŁ»·ŠĪ²£Į§½Į°č°ō£»ÖŠŗĶČČ²ā¶ØŹµŃé³É°ÜµÄ¹Ų¼üŹĒ±£ĪĀ¹¤×÷£¬“óŠ”ÉÕ±Ö®¼äĢīĀśĖéÖ½ĢõµÄ×÷ÓĆŹĒĪĀøōČČ£¬·ĄÖ¹ČČĮæÉ¢Ź§£»
¹Ź“š°øĪŖ£ŗ»·ŠĪ²£Į§½Į°č°ō£»ĪĀøōČČ£¬·ĄÖ¹ČČĮæÉ¢Ź§£»
£Ø2£©±ķÖŠČż“Ī²āĮæŹż¾Ż¶¼ŹĒÓŠŠ§µÄ£¬Čż“ĪĪĀ²īµÄĘ½¾łÖµĪŖ£ŗ$\frac{6.6”ę+6.7”ę+6.8”ę}{3}$=6.7”ę£¬
”÷H=-$\frac{cm”÷t}{n£Ø{H}_{2}O£©}$=-$\frac{4.18”Į1{0}^{-3}KJ/£Øg•”ę£©”Į£Ø50+50£©mL”Į1.00g/mL”Į6.7”ę}{0.05L”Į1.0mol/L}$=-56.0kJ/mol£¬ČČ»Æѧ·½³ĢŹ½ĪŖH+£Øaq£©+OH-£Øaq£©=H2O£Øl£©”÷H=-56.0 kJ/mol£»
¹Ź“š°øĪŖ£ŗH+£Øaq£©+OH-£Øaq£©=H2O£Øl£©”÷H=-56.0kJ/mol£»
ÉŁĮæŃĪĖįŌŚ·“Ó¦ÖŠ»Ó·¢£¬ŃĪĖį»Ó·¢ĪüŹÕČČĮ棬ĒŅŃĪĖįĘ«ÉŁ£¬·Å³öµÄČČĮæĘ«Š”£¬²āµĆµÄÖŠŗĶČČŹżÖµĘ«µĶ£»¹Ź“š°øĪŖ£ŗĘ«µĶ£»
£Ø3£©ÓÉÓŚ“×ĖįĪŖČõĖį£¬“×ĖįµēĄėŅŖĪüŹÕÄÜĮ棬Ōģ³É²āµĆµÄÖŠŗĶČČŹżÖµĘ«Š”£¬µ«ÖŠŗĶČČĪŖ”°-”±£¬ĖłŅŌÖŠŗĶČČĘ«“ó£¬
¹Ź“š°øĪŖ£ŗĘ«“ó£»
£Ø4£©Ć»ÓŠÓĆĖ®Ļ“µÓĪĀ¶Č¼ĘÉĻµÄŃĪĖįČÜŅŗ£¬ŃĪĖįÓėĒāŃõ»ÆÄĘ·“Ó¦·ÅČČ£¬ĒāŃõ»ÆÄʵÄĪĀ¶ČĘ«øߣ¬²āµĆµÄÖŠŗĶČČŹżÖµĘ«Š”£¬µ«ÖŠŗĶČČĪŖ”°-”±£¬ĖłŅŌÖŠŗĶČČĘ«“ó£»
¹Ź“š°øĪŖ£ŗĘ«“ó£®
µćĘĄ ±¾Ģāæ¼²éĮĖÖŠŗĶČČµÄ²ā¶Ø·½·Ø”¢¼ĘĖć”¢Īó²ī·ÖĪö£¬ĢāÄæÄŃ¶Č²»“ó£¬×¢ŅāÕĘĪÕ²ā¶ØÖŠŗĶČȵÄÕżČ··½·Ø£¬Ć÷Č·ŹµŃé²Ł×÷¹ż³ĢÖŠ¹Ų¼üŌŚÓŚ¾”æÉÄܼõÉŁČČĮæÉ¢Ź§£¬Ź¹²ā¶Ø½į¹ūøü¼Ó×¼Č·£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ŗĶ ŗĶ 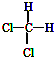 ŹĒĮ½ÖÖÖÖ²»Ķ¬µÄĪļÖŹ ŹĒĮ½ÖÖÖÖ²»Ķ¬µÄĪļÖŹ | |
| B£® | ÓÉŅŅĻ©Ö®¼äµÄĻą»„¼Ó³ÉæÉŅŌµĆµ½¾ŪŅŅĻ© | |
| C£® | ¶”ĶéÓė¶”Ļ©»„ĪŖĶ¬ĻµĪļ | |
| D£® | ŅŅĖį²»ÄÜŹ¹×ĻÉ«ŹÆČļ±äŗģ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | F | B£® | N | C£® | O | D£® | H |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
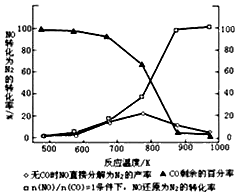 ŅŅ“¼ĘūÓĶŹĒ±»¹ć·ŗŹ¹ÓƵĊĀŠĶĒå½ąČ¼ĮĻ£¬¹¤ŅµÉś²śŅŅ“¼µÄŅ»ÖÖ·“Ó¦ŌĄķĪŖ£ŗ
ŅŅ“¼ĘūÓĶŹĒ±»¹ć·ŗŹ¹ÓƵĊĀŠĶĒå½ąČ¼ĮĻ£¬¹¤ŅµÉś²śŅŅ“¼µÄŅ»ÖÖ·“Ó¦ŌĄķĪŖ£ŗ| ĪĀ¶Č/”ę | 800 | 1000 | 1200 | 1400 |
| Ę½ŗā³£Źż | 0.45 | 1.92 | 276.5 | 1771.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
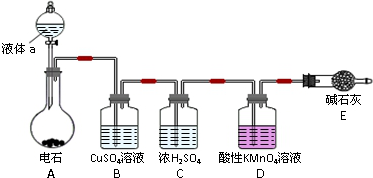
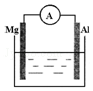 ČēĶ¼ĖłŹ¾×°ÖĆÖŠ£¬½šŹōĆ¾”¢ĀĮŗĶµēĮ÷±ķĶعżµ¼ĻßĻąĮ¬£ŗ
ČēĶ¼ĖłŹ¾×°ÖĆÖŠ£¬½šŹōĆ¾”¢ĀĮŗĶµēĮ÷±ķĶعżµ¼ĻßĻąĮ¬£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com