
【题目】设计方案是实验探究的保证,感悟方法是探究的根本目的。某合作学习小组开展了如下探究:
实验一:检验氢氧化钠溶液中是否含有氢氧化钙。
(分析)从组成上看,氢氧化钙和氢氧化钠都属于碱,它们在水溶液中都能解离出相同的_______(填符号),所以具有相似的化学性质。但由于解离出的Na+和Ca2+不同,所以性质也有不同。设计实验时可加入能解离出CO32﹣的试剂利用CO32﹣与Ca2+结合产生白色沉淀这一特殊现象予以检验。
(设计方案并实验)
实验操作 | 现象 | 结论 | |
方案一 | 取少量待测溶液于试管中,通入CO2 | 出现白色沉淀 | 氢氧化钠溶液中含有氢氧化钙 |
方案二 | 取少量待测溶液于试管中,滴加 _________溶液 | 出现白色沉淀 |
写出上述方案中出现白色沉淀的一个化学方程式__________________________________________。
(方法感悟)在检验物质时,要分析物质的组成和______。据此选择加入恰当的试剂,最后根据不同现象得出结论。
(实验探究)实验二:有一包白色固体,可能含有氯化钠、氢氧化钠、碳酸钠、硫酸钠和硝酸钡中的一种或几种,为探究其组成,某合作学习小组设计方案并进行了如下实验:

(1)上述实验中,过滤操作用到的玻璃仪器有:烧杯、玻璃棒和_________。
(2)小晶同学通过上述实验推知:白色固体样品中一定不含有_________。(填化学式)
(3)为确定白色固体样品中可能存在的物质,小燕对沉淀C进行实验。
实验操作 | 现象 | 结论 |
取少量沉淀C于试管中,加入过量 _________。 | 有气泡产生,沉淀全部消失。 | 白色固体样品中一定含有 ________。 |
(4)小虎同学认为白色固体中还要物质不能确认其是否存在.其理由是:_________________。
(用化学方程式表示)如要确认,只需将上述实验方案中所加的一种试剂改为_______即可。
(方法感悟)若其他物质的存在对所检验的物质有干扰时,可先将干扰物质转化,再选择加入恰当的试剂,最后根据不同现象得出结论。
【答案】OH- K2CO3 (或Na2CO3 或(NH4)2CO3)Ca(OH)2 +CO2═CaCO3 ↓+H2O( 或Ca(OH)2 +Na2CO3═CaCO3 ↓+2NaOH )性质(或化学性质)漏斗Ba(NO3)2稀盐酸(或稀硝酸)Na2CO3BaCl2+2AgNO3=2AgCl↓+ Ba(NO3)2 (或BaCl2+Na2CO3= BaCO3↓+2NaCl)Ba(NO3)2溶液
【解析】
从组成上看,氢氧化钙和氢氧化钠都属于碱,它们在水溶液中都能解离出相同的OH-。溶液中含有氢氧化钙,能和二氧化碳或碳酸盐反应生成沉淀,所以所加入的试剂为可溶性的碳酸盐,可能是K2CO3 (或Na2CO3 或(NH4)2CO3)。氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,方程式为:Ca(OH)2 +CO2═CaCO3 ↓+H2O,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,方程式为Ca(OH)2 +Na2CO3═CaCO3 ↓+2NaOH 。通过实验可以分析物质的组成和化学性质。(1)过滤实验中使用到的仪器有漏斗; (2) 加入过量的氯化钡溶液时,产生白色沉淀C,说明白色固体中含有碳酸钠或硫酸钠或碳酸钠和硫酸钠,当白色固体中含有碳酸钠或硫酸钠时,一定不含硝酸钡,这是因为硝酸钡能和碳酸钠或硫酸钠反应生成白色沉淀。(3)取少量沉淀C于试管中,加入过量的稀盐酸(或稀硝酸),沉淀全部消失,说明白色沉淀是碳酸钡,因此白色固体中一定含有Na2CO3,加入过量的氯化钡溶液和酚酞试液时得到红色溶液,说明白色固体中含有氢氧化钠。(4)加入稀硝酸和硝酸银时产生白色沉淀,不能说明白色固体中含有氯化钠,这是因为加入氯化钡溶液时带入了氯离子,反应方程式为:BaCl2+2AgNO3=2AgCl↓+ Ba(NO3)2(或BaCl2+Na2CO3= BaCO3↓+2NaCl),如要确认是否含有氯化钠,只需要将上述实验方案中所加的过量的氯化钡溶液改为硝酸钡溶液即可。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。请回答下列问题:
(1)已知: H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为1411.0kJ/mol,且H2O(g)=H2O(l)ΔH=-44.0kJ/mol,则CO2 和H2反应生成乙烯和水蒸气的热化学方程式为____________,上述反应在__________下自发进行(填“高温”或“低温”)。
(2)乙烯是一种重要的气体燃料,可与氧气、熔融碳酸钠组成燃料电池。写出该燃料电池负极的电极反应式:_______________________.
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。
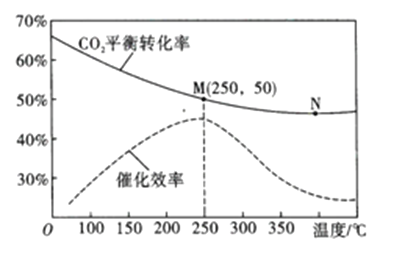
①平衡常数: KM__________KN (填“>”“<”或“=”)。
②下列说法正确的是_________(填序号)。
A.当混合气体密度不变时,说明反应达到平衡状态
B.当压强或n(H2)/n(CO2)不变时,均可证明反应已达平衡状态
C.当温度高于250℃时,因为催化剂的催化效率降低,所以平衡向逆反应方向移动
D.若将容器由“恒容”换为“恒压”,其他条件不变,则CO2的平衡转化率增大
③250℃时,将平衡后的混合气体(不考虑平衡移动) 通入300mL 3mol/L的NaOH溶液中充分反应,则所得溶液中所有离子的浓度大小关系为__________
④图中M点对应乙烯的质量分数为_____________。
(5)达平衡后,将容器体积瞬间扩大至2L并保持不变,平衡向_____移动(填“正向”“逆向”或“不”),容器内混合气体的平均相对分子质量______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式 C2H2 (g) +5/2O2 (g) →2CO2 (g)+H2O(l) △H = —1300kJ / mol 的说法中,正确的是 ( )
A. 当8 NA个电子转移时,该反应放出1300kJ的能量
B. 当1 NA个水分子生成且为液体时,吸收1300kJ的能量
C. 当2 NA个碳氧共用电子对生成时,放出1300kJ的能量
D. 当8 NA个碳氧共用电子对生成时,放出1300kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明酸性溶液中,能共存的离子组是( )
A.NH4+、OH﹣、Al3+、Cl﹣
B.K+、SO42﹣、HCO3﹣、Na+
C.Mg2+、NO3﹣、Cl﹣、Na+
D.MnO4﹣、K+、SO42﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,阿伏加德罗常数为__________ (列式计算,已知Ar(Cu)=63.6);
(2)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为______。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为_______;

(3)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___________,反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过如右图所示装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(1)实验前要首先进行的操作是____________.
(2)现象Ⅰ中白雾的成分是_________(填名称),形成白雾的原因是________.
(3)将现象Ⅰ中得到的黄色气体通入KSCN溶液,溶液变红。则现象Ⅱ中黄色气体除了Cl2还含有________ (填化学式);该物质能使B中KI-淀粉溶液变蓝,发生反应的离子方程式是______.
(4)为了确认现象Ⅱ中黄色气体中含有Cl2,小组提出如下方案:
方案:将B中KI-淀粉溶液替换为NaBr溶液。
现象:B中溶液呈浅橙红色;未检出Fe2+。
a.写出用铁氰化钾溶液检验Fe2+原理的离子方程式:_________
b.方案中检验Fe2+的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是A、B、C、D、E五种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色 ②比例模型为 ③能与水在一定条件下反应生成C |
B | ①由C、H两种元素组成 ②球棍模型为 |
C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊溶液变红 ③可由C发生氧化反应得到 |
回答下列问题:
(1)A~E中,属于烃的是________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为_______。
(3)C催化氧化生成D的化学方程式为_____________________。
(4)有机物B具有的性质是________(填序号)。
①无色无味的溶液;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)写出B与溴在催化剂作用下发生反应的化学方程式为_______。
(6)写出E与C反应生成相对分子质量为88的酯的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com