
| A. | Na2O2和CO2反应中,Na2O2既是氧化剂又是还原剂 | |
| B. | Na2O2、Cl2、SO2使品红溶液褪色的原理相同 | |
| C. | 等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快 | |
| D. | 在Na2O2中阴阳离子所含的电子数目相等 |
分析 A.Na2O2和CO2反应中Na2O2的O化合价既升高又降低;
B.氯气可与水反应生成具有漂白性的次氯酸,Na2O2、次氯酸都是具有强氧化性漂白,二氧化硫具有漂白性,但不稳定;
C.SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,发生:SO2+Cl2+2H2O=H2SO4+2HCl,不再具有漂白性;
D.过氧化钠中阴阳离子分别是O22-和Na+.
解答 解:A.Na2O2和CO2反应中Na2O2的O化合价既升高又降低,所以Na2O2既是氧化剂又是还原剂,故A正确;
B.氯气可与水反应生成具有漂白性的次氯酸,Na2O2、次氯酸都是具有强氧化性漂白,二氧化硫具有漂白性,但不稳定,漂白原理不同,故B错误;
C.SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,发生:SO2+Cl2+2H2O=4H++SO42-+2Cl-,盐酸和硫酸没有漂白性,所以不再具有漂白性,故C错误;
D.过氧化钠中阴阳离子分别是O22-和Na+,一个过氧根离子中含有18个电子,一个钠离子中含有10个电子,所以在过氧化钠中阴阳离子所含的电子数目不相等,故D错误;
故选A.
点评 本题考查较为综合,涉及氧化还原反应概念、漂白原理的判断、氧化还原反应计算、氯气性质与过氧化钠结构等,是对基础知识的考查,难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
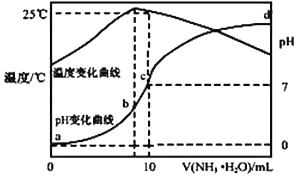 在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a 点 Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b 点:c(NH4+)>c(Cl-)>c(H +)>c(OH -) | |
| D. | 25℃时 NH4Cl 水解常数为(10n-1)×10-7mol•L-1(用 n 表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
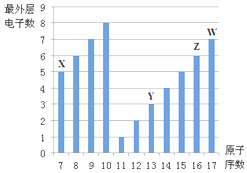 如图是部分短周期元素最外层电子数与原子序数的关系图.
如图是部分短周期元素最外层电子数与原子序数的关系图.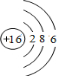 .
.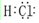 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能生成碱的金属元素都在ⅠA族 | |
| B. | 稀有气体元素原子的最外层电子数为2或8 | |
| C. | 原子序数为14的元素位于元素周期表的第3周ⅥA族 | |
| D. | 元素周期表有18个纵行,分列16个族,即7个主族、8个副族和1个0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的结构式:N=N | B. | F-的结构示意图: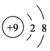 | ||
| C. | 中子数为20 的氯原子:2017Cl | D. | NH3 的电子式: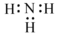 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
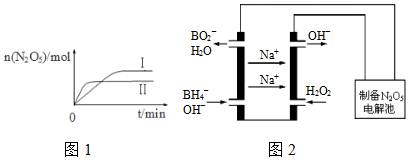
| .01mol/L 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com