
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
A.Q2=![]() B.Q2>
B.Q2>![]() C.Q2<Q1<Q D.Q=Q1>Q2
C.Q2<Q1<Q D.Q=Q1>Q2
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。许多科学家认为从空气中捕获二氧化碳不仅在理论上可行,很快还会成为一个对付全球变暖的实用武器;目前 NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是_________。
A.NH4Cl B.CH3CH2OH C.CaCl2 D.Na2CO3
(2)工业上用NH3捕碳可合成CO (NH2)2:已知:①标准状况下,5.6L NH3与足量CO2完全反应生成NH2CO2 NH4 (s)时放出39.8kJ的热量;②NH2CO2 NH4 (s)= CO(NH2)2(s)+ H2O(g) △H=+72.5 KJ·mol-1,则2NH3(g)+CO2(g)=CO(NH2)2(s)+ H2O(g)的△H=_________KJ·mol-1。
(3)用(NH4)2CO3捕碳的反应如下:(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图(见下图):
2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图(见下图):

①c点的逆反应速率和d点的正反应速率的大小关系为V逆c ____V正d (填“>”、“=”或“<”)。
②b、c、d三点的平衡常数K b、K c、Kd 从小到大的顺序为_______(填“>”、“=”或“<”)。
③在T2~T4温度区间,容器内CO2气体浓度呈现先减小后增大的变化趋势,其原因是______________。
(4)用碱性溶液也可捕碳:在常温下,将0.04molCO2通入200mL0.2mol/L的Na2S溶液中,已知:H2CO3的电离平衡常数:K1=4.3×10—7、K2=5.6×10—11;H2S的电离平衡常数:K1=5.0×10—8、K2=1.1×10—12。回答下列问题:
①发生反应的离子方程式为___________。
②充分反应后下列关系式中正确的是 ___________。
A.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
B.(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
C.c(CO32-)+ c(HCO3-)+ c(H2CO3)>c(H2S)+c(HS-)+c(S2-)
③计算反应后的溶液中c(H2S)c(OH-)/ c(HS-)的值为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式__________。
(2)下列三种情况下,离子方程式与(1)相同的是____(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液中显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO![]() 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
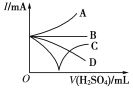
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用右图中的___曲线表示(填序号)。
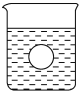
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将____________。
Ⅱ.某地甲、乙两厂排放污水,污水中含有下列8种离子中的4种:Ag+、Ba2+、Fe3+ 、Na+、Cl-、SO42-、NO3-、OH-(两厂所排污水不含相同离子)。两厂单独排放都会造成严重的水污染(其中甲厂的污水是碱性的),如将两厂的污水按一定比例混合,沉淀后的污水变成无色澄清的几乎只含硝酸钠的溶液而排放,污染程度会大大降低。关于两厂所排污水中所含的4种离子,你认为应该是:甲厂:________;乙厂________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类是由 __、____、 __ 三种元素组成的一类有机化合物,糖类又叫做__,原因是它们的化学组成大多数符合通式____。但不是所有的糖符合这个通式且符合这个通式的也不一定是糖。油脂的成分是________,由__组成,结构简式为________。维生素是参与生物 ___和 ______所必需的一类小分子有机化合物,它分为____维生素和____维生素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl制备碳酸氢钠。下列实验装置能达到实验目的的是

A. 用装置甲制取氨气 B. 用装置乙制取二氧化碳
C. 用装置丙制取碳酸氢钠 D. 用装置丁分离碳酸氢钠与母液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO![]() 和泥沙,可将粗盐溶于水,然后进行下列五项操作:
和泥沙,可将粗盐溶于水,然后进行下列五项操作:
①过滤 ②加过量NaOH溶液 ③加适量HCl ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
通过教材中“粗盐的提纯”及你做过的该实验回答下列问题:
(1)以上五步操作中,最后进行的是________。
(2)实验室进行NaCl溶液的蒸发时,一般有以下操作过程:
①固定铁圈位置 ②放置酒精灯 ③放上蒸发皿(蒸发皿中盛有NaCl溶液) ④加热搅拌 ⑤停止加热
正确的操作顺序为___________________。
(3)在粗盐经过一系列操作后的溶液中滴加过量饱和Na2CO3溶液。请问这步操作的目的是___________________________________________。判断Na2CO3溶液已经过量的方法是_________________________________________________________________。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:_________________________________________。
过滤时:_________________________________________。
蒸发时:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 碱性氧化物、金属氧化物、氧化物
C. 胶体、分散系、混合物
D. 复分解反应、置换反应、化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0

下列分析中正确的是
A、图Ⅱ研究的只是t0时使用催化剂对反应速率的影响
B、图Ⅰ研究的是t0时缩小容器体积对反应速率的影响
C、图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D、图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com