
| A. | 物质的量浓度为0.5 mol/L的MgCl 2溶液中,共含有Cl - 个数为 N A | |
| B. | 1mol任何气体的体积都为 22.4L | |
| C. | 7.8gNa 2O 2中所含阴离子的数目是0.1N A | |
| D. | 标准状况下,2.24L水中含有的分子数为0.1N A |
分析 A.溶液体积不明确,无法计算离子数目;
B.气体的体积与温度、压强有关,物质的量相同时,气体体积不一定相同;
C.1molNa2O2含2molNa+和1molO22-;
D.标准状况下,水为液态.
解答 解:A.溶液体积不明确,故溶液中的氯离子的个数无法计算,故A错误;
B.标况下,气体摩尔体积相同为22.4L/mol,所以1mol任何气体在标况下的体积都约为22.4L,故B错误;
C.7.8gNa2O2的物质的量为0.1mol,而1molNa2O2含2molNa+和1molO22-,故0.1molNa2O2含0.1molO22-,阴离子数目为0.1NA,故C正确;
D.标准状况下,水为液态,故不能根据气体摩尔体积来计算其物质的量,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.


科目:高中化学 来源: 题型:选择题
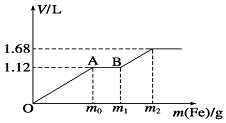 向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )
向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )| A. | 产生的气体中H2的物质的量为0.05mol | |
| B. | AB段发生反应的离子方程式为:Fe3++Fe=2Fe2+ | |
| C. | 所用混合溶液中c(H2SO4)=1.0 mol•L-1 | |
| D. | 反应后溶液中Fe2+的物质的量为0.025 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 颜色和状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g•cm-3 | 660.4℃ | 良好 | 良好 | 良好 |
| 一种猜想 | 验证方法 | 现象 | 结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 性状 | 相对分 子质量 | 溶解度 | |||
| 冷水 | 热水 | 乙醇 | 乙醚 | |||
| 呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
| 呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
| 呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
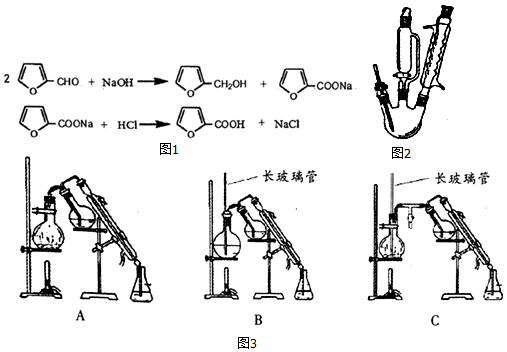
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com