
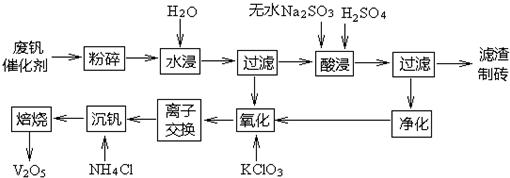
分析 (1)根据V2O5在硫酸工业中作SO2催化氧化为SO3的催化剂解答;
(2)废催化剂中钒元素主要以难溶的V2O5和易溶的VOSO4形式存在,粉碎后水浸后过滤,得到含VOSO4的滤液Ⅰ,和沉淀V2O5;沉淀经酸浸溶解在硫酸中,形成含VO2+离子的溶液,再加入亚硫酸钠,会发生氧化还原反应,V2O5+SO32-+4H+=2VO2++SO42-+2H2O,过滤后得到滤液Ⅱ,成分主要是VOSO4,经分离净化后与水浸液合并,加入氯酸钾氧化,使VOSO4氧化成可溶于水完全电离的(VO2)2SO4,氯元素被还原为Cl-,从而根据氧化还原反应的实质写出离子方程;
(3)根据流程图沉钒得到NH4VO3沉淀的反应为氯化铵和KVO3发生复分解反应,生成难溶性的NH4VO3和KC1;
(4)由(2)中反应的方程式V2O5+SO32-+4H+=2VO2++SO42-+2H2O,C1O3-+6VO2++3H2O=6VO2++6H++C1-,可得关系式:3V2O5~6VO2+~C1O3-,则n(V2O5)=3n(C1O3-)=3n(KC1O3)=3×0.01L×1mol•L-1=0.03mol,100g此废钒催化剂含m(V205)=100g×6%=6g,n(V2O5)=$\frac{6g}{182g/mol}$=$\frac{6}{182}$mol,钒的回收率为:0.03÷$\frac{6}{182}$×100%=91%;
(5)根据氧化还原反应得失电子守恒,算出V2O5还原产物中V元素的化合价,再根据反应前后元素守恒,据此确定生成物中V的存在形式;
(6)电解精炼,粗钒应作阳极,溶解后在阴极析出得纯钒,VCl2可用钒与Cl2直接化合制得.
解答 解:(1)根据V2O5在硫酸工业中作SO2催化氧化为SO3的催化剂,在接触室中进行,
故答案为:接触室;SO2催化氧化;
(2)根据题意和流程图中的转化,“酸浸”是将钒废催化剂中V2O5转变成可溶于水的VOSO4,发生了氧化还原反应;含VOSO4的酸浸液经分离净化后与水浸液(含VOSO4)合并,用氯酸钾氧化,使VOSO4氧化成完全电离可溶于水的(VO2)2SO4,氯元素被还原为Cl-,根据化合价的升降写出离子方程式.
故答案为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O C1O3-+6VO2++3H2O=6VO2++6H++C1-;
(3)根据流程图沉钒得到NH4VO3沉淀的反应为氯化铵和KVO3发生复分解反应,生成难溶性的NH4VO3和KC1,化学方程式为NH4Cl+KVO3=KCl+NH4VO3↓,
故答案为:NH4Cl+KVO3=KCl+NH4VO3↓;
(4)由(2)中反应的方程式V2O5+SO32-+4H+=2VO2++SO42-+2H2O,C1O3-+6VO2++3H2O=6VO2++6H++C1-,可得关系式:3V2O5~6VO2+~C1O3-,则n(V2O5)=3n(C1O3-)=3n(KC1O3)=3×0.01L×1mol•L-1=0.03mol,100g此废钒催化剂含m(V205)=100g×6%=6g,n(V2O5)=$\frac{6g}{182g/mol}$=$\frac{6}{182}$mol,钒的回收率为:0.03÷$\frac{6}{182}$×100%=91%,
故答案为:91%;
(5)根据氧化还原反应得失电子守恒,设生成物中V元素的化合价为x,则$\frac{2.24L}{22.4L}$×2=$\frac{18.2g}{182g/mol}$×(+5-x),x=+4,则V2O5还原产物中V元素的化合价为+4价,再根据反应前后元素守恒,据此确定生成物中V的存在形式为VOC12或VO2+,
故答案为:VOC12或VO2+;
(6)电解精炼,粗钒应作阳极,溶解后在阴极析出得纯钒,VCl2可用钒与Cl2直接化合制得,
故答案为:阳 Cl2.
点评 本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | S、Si、Be | B. | O、C、Mg | C. | O、Si、Ca | D. | S、C、He |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
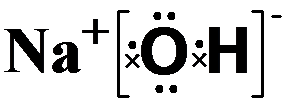 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
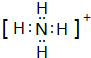 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度的下列溶液,c(NH4+)大小顺序:(NH4)2SO4>NH4HSO4>NH4Cl>NH4HCO3 | |
| B. | 同浓度的下列溶液,pH值大小顺序:Na2CO3>NaClO>NaHCO3>CH3COONa | |
| C. | 用水冲洗BaSO4比用稀硫酸冲洗损失大 | |
| D. | 用惰性电极电解某溶液,两极分别产生H2和O2,pH值一定升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol,则40gNaOH固体与稀盐酸完全中和,放出的热量即为57.3 kJ | |
| B. | 已知C(s)+O2(g)=CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1<△H2 | |
| C. | 已知H2(s)+Cl2(g)=2HCl (g)△H=-184.6 kJ/mol,则反应物总能量小于生成物总能量 | |
| D. | 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液,c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 0.1mol/L K2S溶液中,c(K+)=c(S2-)+c(HS-)+c(H2S) | |
| C. | 常温时pH=2的盐酸和pH=12的氨水中由水电离出的c(H+)相等 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合完全反应后c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 研究目的 | 温度(T) 对反应的影响 | 压强(p)对平衡常数的影响 | 压强(p)对反应的影响(p2>p1) | 温度(T)对反应的影响(T1>T2) |
| 图示 | 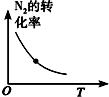 | 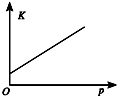 | 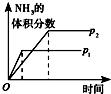 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com