
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
分析 (1)隔一段时间检测,发现pH逐渐减小,酸性增强,发生的反应为:2H2SO3+O2=2H2SO4,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强;
(2)因为酸性物质能和很多物质反应,所以酸雨的危害是很多方面的,如:腐蚀建筑物,毁坏庄稼,使土壤酸化,使水体显酸性,以及树木枯萎等;
(3)根据酸雨的形成分析,大气中的二氧化硫和二氧化氮溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨.
解答 (1)隔一段时间检测,发现pH逐渐减小,酸性增强,发生的反应为:2H2SO3+O2=2H2SO4,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,由此可以得出酸雨形成过程可能是二氧化;硫与水反应SO2+H2O=H2SO3,
故答案为:2H2SO3+O2=2H2SO4;SO2+H2O=H2SO3;
(2)因为酸性物质能和很多物质反应,所以酸雨的危害是很多方面的,如:腐蚀建筑物,毁坏庄稼,使土壤酸化,使水体显酸性,以及树木枯萎等.
故答案为:C;
(3)①对燃烧煤时产生的尾气进行除硫处理,就能减少二氧化硫的排放,所以可以减少酸雨的产生;
②原煤中含有硫、氮元素,少用原煤做燃料,就能减少二氧化硫的排放,所以可以减少酸雨的产生;
③燃煤时鼓入足量空气,只能使燃料燃烧的充分,而不能减少二氧化硫和二氧化氮的排放,所以不能减少酸雨的产生;
④开发清洁能源,能减少二氧化硫的排放,所以可以减少酸雨的产生;
故答案为:C.
点评 本题考查化学环境污染知识,为高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,树立环保意识,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH4Cl、HCl、H2O、H2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | HBr、CO2、NH3、CS2 | D. | Na2O2、H2O2、H2O、O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
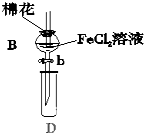 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表中除短周期外,其他周期均有18种元素 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 副族元素中没有非金属元素 | |
| D. | 碱金属元素是指IA族的所有元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42% | B. | 48% | C. | 81% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(CH3COO-)=C(Cl-)=C(H+)>C(CH3COOH) | B. | C(CH3COO-)=C(Cl-)>C(CH3COH)>C(H+) | ||
| C. | C(CH3COO-)>C(Cl-)>C(H+)>C(CH3COOH) | D. | C(CH3COO-)>C(Cl-)>C( CH3COOH)>C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b=c | B. | a>b>c | C. | a>c>b | D. | c>a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com