
【题目】某厂排出的废液主要含有硝酸锌和硝酸银,为了从中回收金属银和硝酸锌,某中学化学课外活动小组设计了以下的实验步骤:

(1)X是____________,Y是____________ (写化学式,下同)。
(2)固体A、滤液B、C的主要成分:A______________,B______________,C______________。
(3)Z处进行的操作是__________________________。
【答案】Zn H2SO4 Zn和Ag Zn(NO3)2 ZnSO4 先过滤,再将滤液蒸发结晶
【解析】
实验的目的是回收金属银和硝酸锌,因此第一步应向混合溶液中加入足量的锌来置换出银,由于锌过量,因此固体A是锌和银的混合物,利用金属活动性的差异可以溶解锌而得到纯净的银,结合滤液C中加入适量的硝酸钡溶液可得液体B,可知Y应为稀硫酸。
(1)我们向废液中加入过量的锌,让锌与硝酸银反应 Zn+2AgNO3=2Ag+Zn(NO3)2然后过滤,得到固体A(Zn和 Ag)和液体B Zn(NO3)2溶液,为了把固体A中的银和锌分开,我们可以加入过量的Y即稀硫酸溶液,故X、Y的化学式:X:Zn,Y:H2SO4;
(2)固体A中加入过量Y即稀硫酸溶液后,其中锌与稀硫酸反应会生成硫酸锌,故滤液C为硫酸锌溶液,故固体A和滤液B、C中主要成分的化学式:A:Ag,Zn;B:Zn(NO3)2;C:ZnSO4;
(3)液体B为Zn(NO3)2溶液,要想得到硝酸锌固体,我们可以对溶液进行加热蒸发,故Z处进行的操作是先过滤,再将滤液蒸发结晶;
故答案为:
(1)X:Zn;Y:H2SO4
(2)A:Ag,Zn;B:Zn(NO3)2;C:ZnSO4;
(3)先过滤,再将滤液蒸发结晶。


科目:高中化学 来源: 题型:
【题目】反应2A(g)2B(g)+C(g)△H>0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是( )
A.减压
B.降温
C.加压
D.增大B的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏;②水洗;③用干燥剂干燥;④10% NaOH溶液洗;⑤水洗;⑥分液。正确的操作顺序是( )
A.②⑥④⑥⑤⑥③①B.①②⑥③④⑤
C.④⑥②⑥③①⑤D.②⑥④⑥①⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,可达到对应实验目的的是( )
实验操作 | 实验目的 | |
A | 苯和溴水混合后加入铁粉 | 制溴苯 |
B | 某有机物与溴的四氯化碳溶液混合 | 确认该有机物含碳碳双键 |
C | 将 | 检验该有机物中的溴原子 |
D | 乙醇与酸性高锰酸钾溶液混合 | 检验乙醇具有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,同种规格的铝片分别与下列物质混合,化学反应速率最大的是( )
A.0.1mol/L的盐酸15mL
B.0.2mol/L的盐酸12mL
C.0.25mol/L的盐酸8mL
D.18mol/L的硫酸15mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知0.05mol某烃在足量的空气中完全燃烧若将产物通入足量的澄清石灰水,得到白色沉淀30.0g若用足量的碱石灰吸收燃烧产物,增重18.6g,则该烃的实验式为___________,;分子式为_______;
若该烃分子中所有碳原子都在一个平面上,其结构简式为________________________
(2)某有机物经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2。分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱如图,则A可能的结构简式_____________________

(3)某烃的含氧衍生物,其分子量小于150,其中含氧元素的质量分数为50%,则其分子中的氧原子个数可能为____________,含氧原子数最多的该有机物的分子式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.25℃时在25 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示.下列说法正确的是__________________
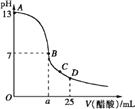
A.滴定终点时俯视读数则测定的氢氧化钠浓度偏高
B.B、C、D三点的溶液中水的电离程度为B>C>D
C.D点,c(CH3COO-)+ c(CH3COOH)>2c(Na+)
D.B点为滴定终点
E.B点时c(CH3COO-)=c(Na+)
F. 若由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,则混合前c(NaOH)< c(CH3COOH)
G.滴定前的氢氧化钠溶液的浓度为0.1mol/L
Ⅱ.(1)为了检验某残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,写出滴定过程中反应的离子方程式:________________________________________KMnO4应装在___________滴定管中(填“酸式”或“碱式”)滴定前是否要滴加指示剂?___(填“是”或“否”),滴定终点的判断方法:_____________________________
(2)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入______________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________。[Fe(OH)3的Ksp=2.6×10-39]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年大部分地区爆发了流感流感常伴随发热高烧等症状。布洛芬是一种常用的儿童退热药,它的BHC合成法如下
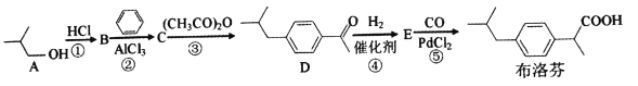
(1)A的名称是__________,B的核磁共振氢谱有__________种吸收峰。
(2)①反应需用浓盐酸而不用稀盐酸,其原因是______________________________。
(3)E的分子式是__________,官能团的名称是__________。
(4)③反应的化学方程式是____________________,反应类型是__________。
(5)满足下列条件的布洛芬的同分异构体有__________种
a遇FeCl3溶液显紫色 b.分子中有5种不同化学环境的氢 c.能发生银镜反应
(6)请写出由苯和( CH3COOCH2CO)2O为原料合成![]() 的线路图(其他试剂任选)___________
的线路图(其他试剂任选)___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com